Oncologie thoracique: les traitements de référence évoluent
Auteur:
Prof. Dr méd. Dr phil. nat. Sacha Rothschild
Kantonsspital Baden
Zentrum für Onkologie & Hämatologie
E-mail: sacha.rothschild@ksb.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Le congrès annuel de l’American Society of Oncology de cette année a de nouveau apporté de nouvelles connaissances intéressantes dans tout le spectre des maladies tumorales, qui vont en partie modifier les options thérapeutiques actuelles. Dans le domaine de l’oncologie thoracique en particulier, le congrès de cette année a présenté des données d’études pertinentes pour la pratique, qui permettront de modifier les traitements de référence dans différents cas.
NSCLC précoce et localement avancé
ADAURA: osimertinib par rapport àplacebo
L’année dernière déjà, j’ai discuté ici des résultats de l’étude ADAURA, car les données sur la survie de l’étude avaient alors été présentées et publiées simultanément dans le New England Journal of Medicine.1,2
Dans cette étude, des patient·es atteint·es d’un cancer du poumon non à petites cellules (NSCLC) de stadeIB–IIIA ayant subi une résection complète et chez qui une mutation classique de l’EGFR a été détectée (délétion de l’exon19 ou mutation ponctuelle L858R dans l’exon21) ont été randomisé·es pour recevoir un traitement adjuvant par l’osimertinib à 80mg/j ou par le placebo pendant trois ans. Les patient·es pouvaient avoir reçu au préalable une chimiothérapie adjuvante si celle-ci était indiquée en raison du stade de la tumeur.
Lors du congrès annuel de l’ASCO de cette année, l’importance d’une maladie résiduelle minime («minimal residual disease» [MRD]) a été analysée sur la base d’une mesure du ctDNA (ADN libre circulant).3 Sur les 682 patient·es inclus·es, 220 ont pu être inclus·es dans l’analyse du ctDNA. Ce dernier a été analysé au moment de la randomisation, puis toutes les 12 semaines pendant les trois premières années, ensuite toutes les 24 semaines jusqu’à la cinquième année et enfin une fois par an.
Les patient·es chez qui le ctDNA était détectable sous traitement présentaient un plus grand risque de présenter une récidive de la maladie. Il s’est écoulé en moyenne 4,7 mois entre la détection du ctDNA et la récidive. La valeur prédictive positive de l’analyse de la MRD était de 91% et la concordance globale de l’analyse du ctDNA avec le risque de récidive était de 82%.
75% des patient·es sous osimertinib n’ont présenté aucune récidive moléculaire (ctDNA, MRD) ou radiologique par rapport à 31% des patient·es sous placebo. L’analyse du ctDNA en tant que paramètre d’évolution sous osimertinib, mais aussi sous d’autres traitements, dont les immunothérapies, fait actuellement l’objet de nombreuses études et devrait modifier notre approche clinique dans un avenir proche.
Au sein du SAKK, nous planifions l’étude SAKK 19/21, grâce à laquelle nous voulons utiliser l’analyse du ctDNA non seulement pour évaluer la réponse, mais aussi comme paramètre d’une adaptation thérapeutique précoce.
NSCLC non résécable: l’étude PACIFIC comme norme pour la quasi-totalité des patient·es
Dans le cas du NSCLC non résécable de stadeIII, le traitement de consolidation par le durvalumab, un inhibiteur anti-PD-L1, est la référence après une radiochimiothérapie, sur la base des données de l’étude PACIFIC.4 Une analyse de sous-groupe des données de 35 patient·es atteint·es de NSCLC avec mutation de l’EGFR n’a montré aucun avantage du traitement d’entretien par le durvalumab, ni en termes de survie sans progression («progression-free survival», PFS) ni en termes de survie globale («overall survival», OS).5
Étude LAURA: traitement d’entretien par l’osimertinib dans le NSCLC non résécable
L’étude de phaseIII LAURA a examiné si un traitement d’entretien par l’osimertinib pouvait apporter un avantage à ces patient·es.6 Elle a été présentée lors du congrès, pendant le symposium des président·es, et publiée le même jour dans le New England Journal of Medicine.7
216 patient·es atteint·es de NSCLC non résécable avec détection d’une mutation de l’EGFR (délétion dans l’exon19 ou mutation ponctuelle L858R dans l’exon21), qui n’ont présenté aucune progression dans les six semaines suivant une radiochimiothérapie combinée, ont été randomisé·es 2:1 pour recevoir un traitement de consolidation par l’osimertinib à la dose standard de 80mg par jour ou un placebo. Le traitement a été poursuivi jusqu’à la progression de la maladie ou l’apparition d’une toxicité de haut grade.
Au moment de l’analyse de l’étude, 56% des patient·es du bras sous osimertinib étaient encore sous traitement par rapport à seulement 10% des patient·es sous placebo. Dans le bras sous placebo, 81% des patient·es présentant une progression ont reçu un traitement par l’osimertinib.
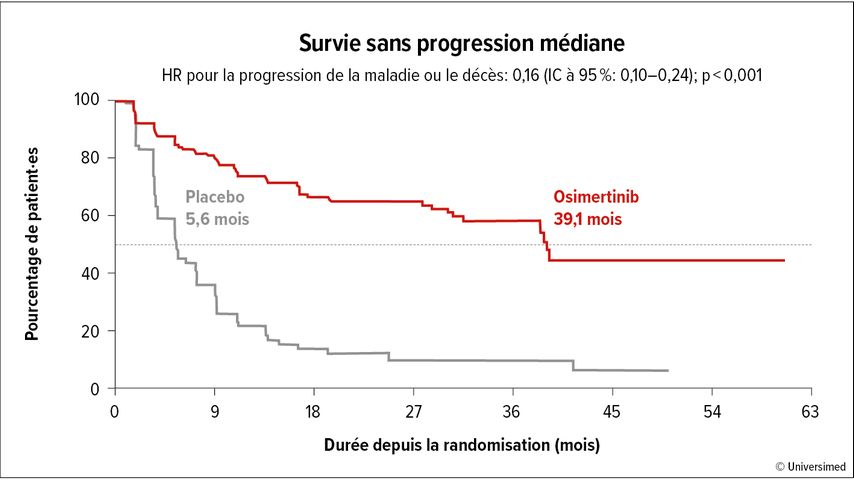
Le critère d’évaluation primaire de l’étude était la PFS, qui a été significativement prolongée de 5,6 à 39,1 mois (Hazard Ratio [HR]: 0,16; intervalle de confiance [IC] à 95%: 0,10–0,24; p<0,001) (Fig.1). En particulier, le traitement de consolidation par l’osimertinib a permis de prévenir l’apparition de métastases cérébrales. 29% des patient·es sous placebo ont présenté des métastases cérébrales par rapport à seulement 8% sous osimertinib.
Fig.1: La survie sans progression sous traitement d’entretien par l’osimertinib dans l’étude LAURA (modifiée selon Lu S et al.)7
Pour la survie globale, une analyse intérimaire a été présentée, qui n’a montré aucune différence statistique entre les deux bras. La survie médiane était de 54,0 mois dans le bras sous osimertinib et n’a pas encore été atteinte dans le bras sous placebo (HR: 0,81; IC à 95%: 0,42–1,56; p=0,530).
Aucun événement inattendu n’est survenu concernant les effets secondaires. Le taux de pneumopathies interstitielles était de 8%, la majorité des événements étant de bas grade (grade1–2).
En résumé, l’étude LAURA est positive et montre une réduction significative des taux de récidive. Un avantage en termes de survie globale n’a pas encore été constaté. Il est important de noter que le stadeIII peut faire l’objet d’un traitement curatif et qu’une prolongation de la survie globale serait donc d’une importance primordiale.
Un allongement du délai jusqu’aux récidives, en particulier au niveau du cerveau, peut toutefois représenter un avantage pour les patient·es, qui doit être évalué de manière critique en tenant compte des effets secondaires et des coûts du traitement non limité dans le temps suivi jusqu’à la progression.
NSCLC métastatique
Les translocations ALK se produisent chez 3 à 5% des patient·es atteint·es de NSCLC et sont plus fréquentes dans les adénocarcinomes, chez les jeunes patient·es et les non-fumeur·euses.8
Plusieurs études ont démontré qu’une inhibition spécifique de l’ALK par le crizotinib, un inhibiteur de tyrosine kinase, était supérieure à une chimiothérapie conventionnelle.9,10 Entre-temps, plusieurs études ont également mis en évidence la supériorité d’inhibiteurs de l’ALK plus récents et plus spécifiques par rapport au crizotinib. En Suisse, l’alectinib, le brigatinib et le lorlatinib sont autorisés pour le traitement de première ligne du NSCLC métastatique ALK-positif.
Étude CROWN: comparaison du lorlatinib et du crizotinib
Dans l’étude de phaseIII randomisée CROWN, 296 patient·es atteint·es de NSCLC ALK-positif n’ayant reçu aucun traitement antérieur ont été randomisé·es pour recevoir le lorlatinib ou le crizotinib.11 Dès la première analyse, une prolongation de la PFS a été démontrée comme critère d’évaluation primaire. Les données après un suivi de cinq ans ont été présentées lors du congrès de l’ASCO12 et publiées simultanément dans le Journal of Clinical Oncology.13
Après une durée de suivi médiane de 60,2 mois, la PFS médiane n’était pas encore atteinte chez les patient·es sous lorlatinib et était de 9,1 mois sous crizotinib (HR: 0,19; IC à 95%: 0,13–0,27). L’avantage impressionnant du lorlatinib a été démontré dans tous les sous-groupes, en particulier chez les patient·es présentant des métastases cérébrales, qui ont pu être inclus·es dans l’étude à condition que les métastases soient asymptomatiques.
L’apparition de métastases cérébrales est l’un des défis cliniques auxquels sont confronté·es les patient·es atteint·es de NSCLC ALK-positif. Le lorlatinib a permis de prolonger significativement le délai jusqu’à la progression intracrânienne (délai médian: non atteint par rapport à 16,4 mois; HR: 0,06%; IC à 95%: 0,03–0,12). Le profil de toxicité du lorlatinib doit notamment tenir compte des modifications métaboliques (hypertriglycéridémie, hypercholestérolémie), des effets secondaires neurologiques (neuropathie périphérique, modifications neurocognitives) et des œdèmes. Une réduction de la dose est nécessaire chez environ un quart des patient·es. L’étude CROWN a également montré que les ajustements de la dose n’étaient pas associés à une réduction de l’efficacité. Malgré une longue période de suivi, les données sur la survie globale ne sont pas encore matures, de sorte que cette analyse est encore en cours.
Avec ces données impressionnantes à long terme issues de l’étude CROWN, le lorlatinib devient le traitement privilégié en première ligne du NSCLC métastatique ALK-positif. Même s’il n’existe aucune comparaison directe avec les autres inhibiteurs de l’ALK plus récents, la comparaison des données des différentes études suggère une supériorité du lorlatinib, bien qu’il faille tenir compte ici du spectre différent des effets secondaires, brièvement discuté ci-dessus.
Étude PALOMA-3: comparaison de l’amivantamab SC et IV
Le traitement du NSCLC métastatique avec mutation de l’EGFR est en pleine évolution. L’amivantamab, un anticorps bispécifique anti-EGFR/MET, a donné des résultats intéressants dans le NSCLC métastatique avec mutation de l’EGFR.
Lors du congrès annuel de l’ASCO, les données de l’étude PALOMA-3 ont été présentées, dans laquelle l’administration par voie sous-cutanée d’amivantamab a été comparée à l’administration par voie intraveineuse chez des patient·es atteint·es de NSCLC métastatique et réfractaire avec mutation de l’EGFR.14 L’administration SC n’était pas inférieure à l’administration IV et était mieux tolérée.
Étude MARIPOSA: comparaison de l’amivantamab
L’étude à trois bras MARIPOSA a comparé l’amivantamab associé au lazertinib, un inhibiteur de tyrosine kinase (ITK) anti-EGFR, à l’osimertinib et au lazertinib seul.15,16
Elle a porté sur 1074 patient·es, randomisé·es 2:2:1. Le critère d’évaluation primaire était la comparaison de la PFS entre l’amivantamab+lazertinib et l’osimertinib seul; il a été atteint.
La PFS médiane a été prolongée de 16,6 à 23,7 mois (HR: 0,70; IC à 95%: 0,58–0,85; p<0,001). L’efficacité était indépendante de la présence de métastases cérébrales ou hépatiques et était encore plus grande chez les patient·es présentant une co-mutation de TP53 au pronostic défavorable.
Les patient·es présentant des mutations atypiques de l’EGFR ont un moins bon pronostic que ceux présentant des mutations classiques dans l’exon19 et l’exon21.17 Les ITK anti-EGFR classiques n’ont qu’une activité limitée.
Étude CHRYSALIS-2: amivantamab+lazertinib
L’étude CHRYSALIS-2 a évalué l’activité de l’association amivantamab+lazertinib chez des patient·es atteint·es de NSCLC métastatique avec mutation atypique de l’EGFR.18 Au total, 105 patient·es ont été inclus·es dans l’étude, dont 49 étaient naïf·ves de traitement.
Le taux de réponse global était de 52%, soit 57% chez les patient·es n’ayant reçu aucun traitement antérieur et 48% chez les patient·es ayant déjà reçu un traitement. La durée de la réponse était de 21 et 17 mois, respectivement, et la PFS médiane a été estimée à 19,5 mois en première ligne et à 7,8 mois dans les autres lignes de traitement.
Les effets secondaires les plus importants sous amivantamab sont des réactions liées à la perfusion, une toxicité cutanée, des œdèmes et une hypoalbuminémie.
Étude WUKONG1: comparaison de sunvozertinib 20 et 30mg
Une autre substance, le sunvozertinib, un ITK sélectif de l’EGFR, a été présentée comme ayant une activité en présence de mutations par insertion dans l’exon20 de l’EGFR.19 Dans cette étude de phaseII à un bras, 107 patient·es atteint·es de NSCLC métastatique et présentant une mutation par insertion dans l’exon20 de l’EGFR ont été inclus·es et traité·es par le sunvozertinib à deux doses différentes (20 ou 30mg).
Un taux de réponse de 53,3% et un taux de réponse intracérébrale de 44,9% ont été observés. Le sunvozertinib a présenté un bon profil de tolérance, la diarrhée étant l’effet secondaire le plus fréquent.
Étude KRYSTAL-12: comparaison d’adagrasib et de docétaxel en deuxième ligne
Les mutations de KRAS sont les altérations moléculaires les plus fréquentes du NSCLC et sont présentes chez environ 30% des patient·es dans les pays occidentaux. La mutation KRAS-G12C est l’altération de KRAS la plus fréquente dans le NSCLC. Différents inhibiteurs spécifiques de KRAS-G12C sont actuellement à l’étude.
L’un d’eux est l’adagrasib, qui a été comparé au docétaxel en deuxième ligne dans l’étude de phaseIII randomisée KRYSTAL-12.20 453 patient·es atteint·es de NSCLC métastatique avec mutation de KRAS-G12C et ayant déjà reçu une chimiothérapie à base de platine ainsi qu’un inhibiteur de PD-(L)1 ont été inclus·es et randomisé·es 2:1.
Le critère d’évaluation primaire était la PFS, qui a pu être prolongée de manière significative. La PFS médiane était respectivement de 5,5 et 3,8 mois (HR: 0,58; IC à 95%: 0,45–0,76; p<0,0001). La probabilité de réponse a également été améliorée (32% par rapport à 9%), notamment le taux de réponse intracérébrale en présence de métastases cérébrales (24% par rapport à 11%). L’analyse des données sur la survie globale est encore en cours.
Olomorasib+pembrolizumab
Plusieurs autres inhibiteurs spécifiques de KRAS-G12C font actuellement l’objet de différentes études cliniques, en monothérapie ou en association avec une chimiothérapie ou une immunothérapie.
Pour l’inhibiteur olomorasib, des données ont été présentées sur le traitement combiné avec l’anticorps anti-PD-1 pembrolizumab.21
Cette étude de phaseI a montré une bonne tolérance générale du traitement et un taux de réponse de 77% chez les patient·es n’ayant reçu aucun traitement antérieur et de 40% chez les patient·es ayant déjà reçu un traitement. La grande majorité de ces patient·es avaient déjà reçu une immunothérapie et près de la moitié avaient également reçu un autre inhibiteur de KRAS-G12C dans le cadre d’un traitement antérieur.
Cancer bronchique à petites cellules
Dans le cas du cancer bronchique à petites cellules non métastatique («limited disease small cell lung cancer», LD-SCLC), la radiochimiothérapie combinée à base de cisplatine/étoposide est le traitement de référence. Dans le cas du cancer bronchique à petites cellules métastatique («extensive disease small cell lung cancer», ED-SCLC), la chimio-immunothérapie combinée à base de platine/étoposide en association avec l’atézolizumab ou le durvalumab s’est établie comme traitement de référence sur la base de deux études de phaseIII randomisées.22,23
Étude BEAT-SC: bévacizumab en association
L’étude BEAT-SC a examiné si le traitement par le bévacizumab en association avec le platine/étoposide et l’atézolizumab pouvait améliorer encore le pronostic.24
La PFS en tant que critère d’évaluation primaire a été significativement prolongée de 1,3 mois (PFS médiane: 4,4 par rapport à 5,7 mois; HR: 0,70; IC à 95%: 0,54–0,90; p=0,0060). La survie globale était toutefois numériquement meilleure dans le bras de contrôle (OS médiane: 16,6 par rapport à 13,0; HR: 1,22; IC à 95%: 0,89–1,67; p=0,2212). Malgré un bénéfice faible mais significatif en termes de temps sans progression, cette association ne peut pas être recommandée.
Étude ADRIATIC: le durvalumab dans le LD-SCLC
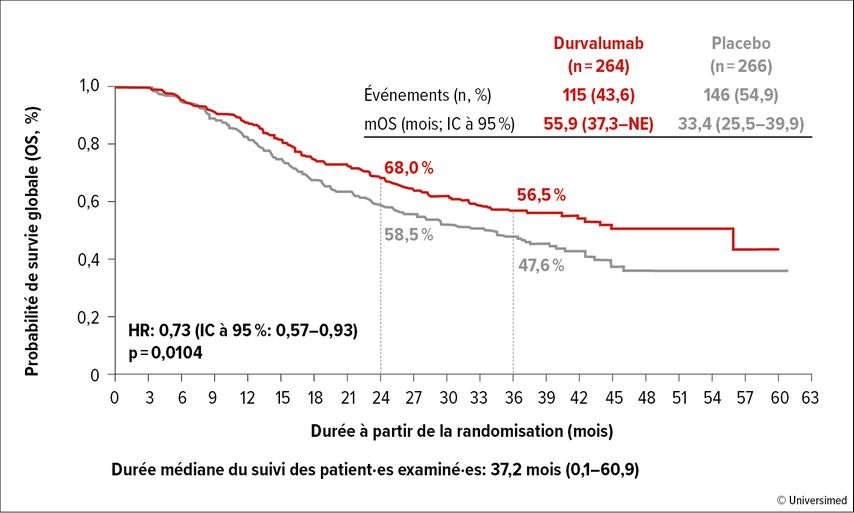
L’étude ADRIATIC a évalué la place de l’immunothérapie par le durvalumab, un anticorps anti-PD-L1, dans le LD-SCLC.25 Dans cette étude, 730 patient·es atteint·es de LD-SCLC qui n’ont présenté aucune progression après une radiochimiothérapie combinée ont été randomisé·es pour recevoir 1500mg de durvalumab toutes les quatre semaines ou un placebo. Le traitement a été poursuivi pendant deux ans au maximum ou jusqu’à la progression. Les critères d’évaluation primaires étaient la PFS et l’OS.
La survie globale médiane a pu être prolongée de 33,4 à 55,9 mois grâce à un traitement d’entretien par le durvalumab (Fig.2; HR: 0,73; IC à 95%: 0,57–0,93; p=0,0104). La PFS a également été prolongée de manière significative.
Le taux de toxicité de haut grade était de 24,4% dans le bras sous durvalumab et de 24,2% dans le bras sous placebo. 16,4% des patient·es sous durvalumab ont arrêté le traitement en raison d’effets secondaires. Ce taux était de 10,6% dans le bras sous placebo.
Le traitement d’entretien par le durvalumab entraîne donc une prolongation significative de la survie globale et s’établira comme le nouveau traitement de référence dans le LD-SCLC.
Mésothéliome
Dans le mésothéliome pleural avancé, la chimiothérapie en association avec le bévacizumab est le traitement de première ligne établi sur la base de l’étude MAPS.26 L’étude CheckMate 743 a comparé une immunothérapie combinée à base d’ipilimumab/nivolumab avec une chimiothérapie à base de platine/pémétrexed27 et a pu démontrer une augmentation de la survie globale sous immunothérapie.
Une analyse de sous-groupe a montré que l’avantage était limité aux patient·es présentant une histologie non épithélioïde. L’utilité de l’immunothérapie en cas d’histologie non épithélioïde a été confirmée dans de nombreuses autres études.
Étude BEAT-meso: histologie épithélioïde/non épithélioïde
Dans l’étude BEAT-meso de l’ETOP, qui vient d’être présentée, des patient·es atteint·es de mésothéliome pleural avancé n’ayant reçu aucun traitement antérieur ont été randomisé·es pour recevoir une chimiothérapie à base de carboplatine/pémétrexed en association avec le bévacizumab ou le même traitement plus l’anticorps anti-PD-L1 atézolizumab.28 Le critère d’évaluation primaire de l’étude était la survie globale.
Le taux de survie global n’a pas pu être amélioré et s’élevait respectivement à 38% et 40% à deux ans (HR: 0,84; IC à 95%: 0,66–1,06; p=0,14). L’analyse était stratifiée par sous-type histologique (épithélioïde par rapport à non-épithélioïde). En cas d’histologie non épithélioïde, l’immunothérapie a de nouveau montré un bénéfice clair et significatif. Le taux de survie à deux ans a été doublé, passant de 14% à 29% (HR: 0,50; 0,32–0,78; p=0,0022). L’expression de PD-L1 n’était pas prédictive du bénéfice de l’immunothérapie. La PFS a été significativement prolongée sous l’association avec l’immunothérapie dans l’ensemble de la population (HR: 0,72; IC à 95%: 0,59–0,89; p=0,0020). Le traitement combiné par chimiothérapie, anticorps anti-VEGF et inhibiteur de point de contrôle immunitaire a montré une toxicité accrue, avec également plus de décès liés au traitement. Cette quadrithérapie ne s’établira donc pas comme la nouvelle référence. L’étude souligne toutefois le bénéfice de l’immunothérapie dans le mésothéliome pleural non épithélioïde.
Littérature:
1 Herbst RS et al.: Overall survival analysis from the ADAURA trial of adjuvant osimertinib in patients with resected EGFR-mutated (EGFRm) stage IB–IIIA non-small cell lung cancer (NSCLC). J Clin Oncol 2023; 41(Suppl. 17): Abstr. #LBA3 2 Tsuboi M et al.: Overall survival with osimertinib in resected EGFR-mutated NSCLC. N Engl J Med 2023; 389(2): 137-47 3 John T et al.: Molecular residual disease (MRD) analysis from the ADAURA trial of adjuvant (adj) osimertinib in patients (pts) with resected EGFR-mutated (EGFRm) stage IB–IIIA non-small cell lung cancer (NSCLC). J Clin Oncol 2024; 42(Suppl. 16): Abstr. #8005 4 Spigel DR et al.: Five-year survival outcomes from the PACIFIC trial: durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. J Clin Oncol 2022; 40(12): 1301-11 5 Naidoo J et al.: Brief report: durvalumab after chemoradiotherapy in unresectable stage III EGFR-mutant NSCLC: a post hoc subgroup analysis from PACIFIC. J Thorac Oncol 2023; 18(5): 657-63 6 Ramalingam SS et al.: Osimertinib (osi) after definitive chemoradiotherapy (CRT) in patients (pts) with unresectable stage (stg) III epidermal growth factor receptor-mutated (EGFRm) NSCLC: Primary results of the phase 3 LAURA study. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #LBA4 7 Lu S et al.: Osimertinib after chemoradiotherapy in stage III EGFR-mutated NSCLC. N Engl J Med 2024; 391(7): 585-97 8 Koivunen JP et al.: EML4-ALK fusion gene and efficacy of an ALK kinase inhibitor in lung cancer. Clin Cancer Res 2008; 14(13): 4275-83 9 Shaw AT et al.: Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med 2013; 368(25): 2385-94 10 Solomon BJ et al.: First-line crizotinib versus chemotherapy in ALK-positive lung cancer. NEngl J Med 2014; 371(23): 2167-7 11 Shaw AT et al.: First-line lorlatinib or crizotinib in advanced ALK-positive lung cancer. N Engl J Med 2020; 383(21): 2018-29 12 Solomon BJ et al.: Lorlatinib vs crizotinib in treatment-naïve patients with advanced ALK+ non-small cell lung cancer: 5-year progression-free survival and safety from the CROWN study. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #80030 13 Solomon BJ et al.: Lorlatinib versus crizotinib in patients with advanced ALK-positive non-small cell lung cancer: 5-year outcomes from the phase III CROWN study. J Clin Oncol 2024; doi.org/10.1200/JCO.24.00581 14 Leighl NB et al.: Subcutaneous amivantamab vs intravenous amivantamab, both in combination with lazertinib, in refractory EGFR-mutated, advanced non-small cell lung cancer (NSCLC): Primary results, including overall survival (OS), from the global, phase 3, randomized controlled PALOMA-3 trial. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #LBA8505 15 Felip E et al.: Amivantamab plus lazertinib vs osimertinib in first-line EGFR-mutant advanced non-small cell lung cancer (NSCLC) with biomarkers of high-risk disease: a secondary analysis from the phase 3 MARIPOSA study. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #8005 16 Cho BC et al.: Amivantamab plus lazertinib in previously untreated EGFR-mutated advanced NSCLC. NEngl J Med 2024; doi:10.1056/NEJMoa2403614 17 Oxnard GR et al.: Natural history and molecular characteristics of lung cancers harboring EGFR exon 20 insertions. J Thorac Oncol 2013; 8(2): 179-84 18 Cho BC et al.: Amivantamab plus lazertinib in atypical EGFR-mutated advanced non-small cell lung cancer (NSCLC): results from CHRYSALIS-2. J Clin Oncol 2024; 42(Suppl. 16): Abstr. #8516 19 Yang JCH et al.: A multinational pivotal study of sunvozertinib in platinum pretreated non-small cell lung cancer with EGFR exon 20 insertion mutations: primary analysis of WU-KONG1 study. J Clin Oncol 2024; 42(Suppl. 16): Abstr. #8513 20 Mok TSK et al.: KRYSTAL-12: phase 3 study of adagrasib versus docetaxel in patients with previously treated advanced/metastatic non-small cell lung cancer (NSCLC) harboring a KRASG12C mutation. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #LBA8509 21 Burns TF et al.: Efficacy and safety of olomorasib (LY3537982), asecond-generation KRAS G12C inhibitor (G12Ci), in combination with pembrolizumab in patients with KRAS G12C-mutant advanced NSCLC. J Clin Oncol 2024; 42(Suppl. 16): Abstr. #LBA8510 22 Horn L et al.: First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med 2018; 379(23): 2220-9 23 Paz-Ares L et al.: Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomised, controlled, open-label, phase 3 trial. Lancet 2019; 394(10212): 1929-39 24 Ohe Y et al.: BEAT-SC: a randomized phase III study of bevacizumab or Placebo in combination with atezolizumab and platinum-based chemotherapy in patients with extensive-stage small cell lung cancer (ES-SCLC). JClin Oncol 2024; 42(Suppl. 16): Abstr. #8001 25 Spigel DR et al.: ADRIATIC: durvalumab (D) as consolidation treatment (tx) for patients (pts) with limited-stage small-cell lung cancer (LS-SCLC). J Clin Oncol 2024; 42(Suppl. 17): Abstr. #LBA5 26 Zalcman G et al.: Bevacizumab for newly diagnosed pleural mesothelioma in the Mesothelioma Avastin Cisplatin Pemetrexed Study (MAPS): a randomised, controlled, open-label, phase 3 trial. Lancet 2016; 387(10026): 1405-14 27 Baas P et al.: First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial. Lancet 2021; 397(10272): 375-86 28 Popat S et al.: BEAT-meso: a randomized phase III study of bevacizumab (B) and standard chemotherapy (C) with or without atezolizumab (A), as first-line treatment (TX) for advanced pleural mesothelioma (PM) — results from the ETOP 13-18 trial. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #LBA8002
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...