Options sans chimiothérapie dans différents sous-groupes
Auteur:
Prof. Dr méd. Jens Huober
Brustzentrum, Kantonsspital St. Gallen
E-mail: jens.huober@kssg.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Dans la prise en charge du cancer du sein avancé HR positif/HER2 négatif, on dispose désormais d’un paysage thérapeutique varié. Les approches ciblées, en plus de l’endocrinothérapie, permettent de couvrir un large éventail de patient·es.
Les études PALOMA-2, MONALEESA-2 et MONARCH3 ont montré que l’ajout du palbociclib, du ribociclib ou de l’abémaciclib, des inhibiteurs de CDK4/6, à l’endocrinothérapie (ET) en première ligne du cancer du sein avancé positif pour les récepteurs hormonaux (HR)/négatif pour HER2 prolongeait significativement la survie sans progression (PFS).1–3 En cas de nouvelle progression, une option consiste à changer d’endocrinothérapie tout en poursuivant l’inhibition de CDK4/6. Cette stratégie a été mise en œuvre avec succès dans l’étude postMONARCH et l’étude MAINTAIN.4,5 Une évaluation définitive de cette stratégie n’a toutefois pas encore été réalisée.
Acteurs de la voie PI3K/AKT/mTOR
Dans le cas du cancer du sein HR positif, la voie PI3K/AKT/mTOR joue un rôle central, sur laquelle agissent différents agents thérapeutiques. Dans l’étude SOLAR, considérée comme l’étude de référence pour l’inhibition de PI3K, les patient·es dont la maladie avait progressé pendant ou après le traitement par inhibiteur de l’aromatase (IA) ont reçu soit le fulvestrant en association avec l’alpélisib, soit le fulvestrant avec un placebo.6
Le groupe avec mutation PI3K a bénéficié de manière significative et cliniquement pertinente de l’association (PFS médiane: 11,0 vs 5,7 mois; HR: 0,65). Dans un très petit groupe de patient·es ayant déjà reçu un traitement par inhibiteur de CDK4/6 (n=20), le traitement d’association à base d’alpélisib a également apporté un bénéfice (5,5 mois vs 1,8 mois; HR: 0,48). L’ajout du capivasertib, un inhibiteur de l’AKT, au fulvestrant s’est également avéré bénéfique dans l’étude CAPItello.7 La maladie des patient·es avaient progressé sous traitement par inhibiteurs de l’aromatase (IA) en situation adjuvante ou métastatique. Comparativement au schéma placebo plus fulvestrant, il en a résulté une prolongation significative et cliniquement pertinente de la PFS, tant dans la population globale (7,2 vs 3,6 mois; HR: 0,60) que dans le groupe présentant des altérations de la voie AKT (7,3 vs 3,1 mois; HR: 0,50). Les patient·es prétraité·es par un inhibiteur de CDK4/6 (70%) ont également bénéficié du schéma capivasertib plus fulvestrant.
Palbociclib plus inavolisib
L’étude INAVO120 a évalué l’association de l’inhibiteur CDK4/6 palbociclib et de l’inhibiteur PI3Kα inavolisib chez des patient·es atteint·es d’un cancer du sein HR positif avec mutation de PIK3CA et ayant progressé pendant ou après une ET adjuvante. Le schéma placebo plus palbociclib a été utilisé comme schéma de comparaison. Le fulvestrant a également été administré dans les deux bras. L’ajout de l’inavolisib a entraîné une augmentation significative de la PFS médiane, qui est passée de 7,3 à 15,0 mois (HR: 0,43).8 Une prolongation du délai avant la chimiothérapie a également été démontré dans le bras expérimental (non atteint vs 15,0 mois; HR: 0,54).9
L’étude EMERALD a permis d’obtenir des données déterminantes sur l’élacestrant, un dégradeur sélectif des récepteurs œstrogéniques. Dans cette étude, des patient·es atteint·es d’un cancer du sein métastatique HR positif ayant déjà reçu des endocrinothérapies et, obligatoirement, un traitement par inhibiteur de CDK4/6, ont été randomisé·es pour recevoir l’élacestrant ou une endocrinothérapie au choix (généralement du fulvestrant, 70%). L’élacestrant s’est révélé particulièrement efficace dans la population porteuse d’une mutation ESR1 (PFS médiane: 3,78 vs 1,87 mois; HR: 0,504).10 La différence de PFS était encore plus marquée dans le sous-groupe ayant reçu au préalable un inhibiteur de CDK4/6 pendant au moins un an (8,61 vs 1,91 mois; HR: 0,410).11
ADC: T-DXd et SG
Les conjugués anticorps-chimiothérapie (ADC), comme le trastuzumab déruxtécan (T-DXd), étudié dans l’étude DESTINY-Breast04 dans le cancer du sein HER2 low (c’est-à-dire HER2 1+ ou 2+/FISH–), sont très intéressants.12 Dans la cohorte HR positive (90% des patient·es), T-DXd vs TPC (chimiothérapie au choix de l’investigateur) a entraîné des prolongations significatives de la PFS (9,6 vs 4,2 mois; HR: 0,37) et de la survie globale (OS; 23,9 vs 17,6 mois; HR: 0,69).
L’étude DESTINY-Breast06 comprenait aussi des patient·es présentant des tumeurs HER2 ultralow (c’est-à-dire une coloration de <10% des cellules). En outre, les patient·es avaient tous/toutes une tumeur HR positive et étaient moins fortement prétraité·es (pas de chimiothérapie en phase métastatique).13 Par rapport à la TPC, le T-DXd a permis d’obtenir des prolongations de la PFS aussi bien pour les cancers HER2 low (13,2 vs 8,1 mois; HR: 0,62) que pour la maladie HER2 ultralow (13,2 vs 8,3 mois; HR: 0,78).
Dans l’étude TROPiCS-02, le sacituzumab govitecan, un ADC ciblant Trop2, a prolongé la PFS médiane (5,5 vs 4,0 mois; HR: 0,65) et l’OS (14,5 vs 11,2 mois; HR: 0,79) par rapport au TPC chez des patient·es massivement prétraité·es.14 De même, dans l’étude TROPION-Breast01, le datopotamab déruxtécan, un ADC ciblant Trop2, a significativement amélioré la PFS dans le cancer HR+/HER2– après différentes thérapies préalables, y compris l’inhibition de CDK4/6, par rapport à une chimiothérapie au choix de l’investigateur (6,9 vs 4,5 mois; HR: 0,64).15
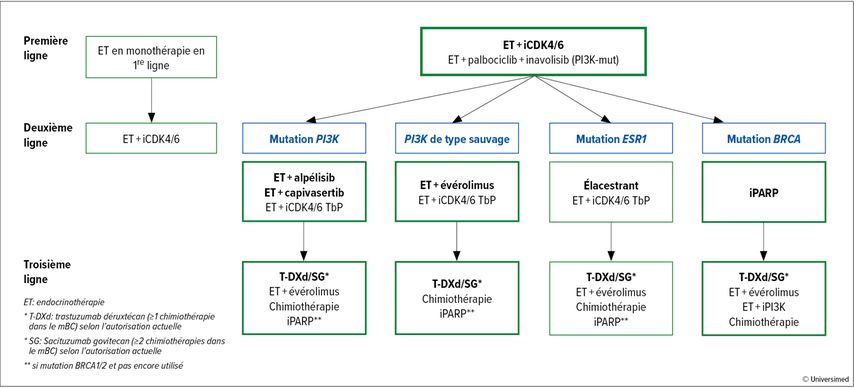
Un algorithme actuel pour le traitement du cancer du sein HR+/HER2– avec une récidive pendant ou après l’ET adjuvante prévoit pour la majorité des patient·es un traitement de première ligne par ET et inhibition de CDK4/6 (Fig.1). Ensuite, une approche individualisée est envisageable en fonction de la configuration génétique, et le T-DXd ainsi que le SG sont disponibles dans les autres lignes de traitement. Il faut également toujours penser à une mutation BRCA1 ou 2 comme cible supplémentaire, car des thérapies ciblées par inhibiteurs de PARP sont disponibles dans ces cas.
Fig.1: Algorithme thérapeutique dans le cancer du sein à récepteurs œstrogéniques positifs/HER2 négatif avec récidive après ou pendant l’endocrinothérapie adjuvante (les traitements de prédilection sont mis en évidence en gras, les autres sont d’autres options possibles)
Littérature:
1 Finn RS et al.: Palbociclib and letrozole in advanced breast cancer. N Engl J Med 2016; 375(20): 1925-36 2 Hortobagyi GN et al.: Ribociclib as first-line therapy for HR-positive, advanced breast cancer. N Engl J Med 2016; 375(18): 1738-48 3 Goetz MP et al.: MONARCH 3: abemaciclib as initial therapy for advanced breast cancer. J Clin Oncol 2017; 35(32): 3638-46 4 Kalinsky K et al.: Abemaciclib plus fulvestrant vs fulvestrant alone for HR+, HER2- advanced breast cancer following progression on a prior CDK4/6 inhibitor plus endocrine therapy: primary outcome of the phase 3 postMONARCH trial. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #LBA1001 5 Kalinsky K et al.: Randomized phase II trial of endocrine therapy with or without ribociclib after progression on cyclin-dependent kinase 4/6 inhibition in hormone receptor-positive, human epidermal growth factor receptor 2-negative metastatic breast cancer: MAINTAIN trial. J Clin Oncol 2023; 41(24): 4004-13 6 André F et al.: Alpelisib for PIK3CA-mutated, hormone receptor-positive advanced breast cancer. NEngl J Med 2019; 380(20): 1929-40 7 Turner N et al.: Capivasertib and fulvestrant for patients with aromatase inhibitor-resistant hormone receptor-positive/human epidermal growth factor receptor 2-negative advanced breast cancer: results from the Phase III CAPItello-291 trial. SABCS 2022; Abstr. #GS3-04 8 Jhaveri KL et al.: Inavolisib or placebo in combination with palbociclib and fulvestrant in patients with PIK3CA-mutated, hormone receptor-positive, HER2-negative locally advanced or metastatic breast cancer: phase III INAVO120 primary analysis. SABCS 2023; Poster #PD1-02 9 Juric D et al.: First-line inavolisib/placebo + palbociclib + fulvestrant in patients with PIK3CA-mutated, hormone receptor-positive, HER2 negative locally advanced/metastatic breast cancer who relapsed during/within 12 months of adjuvant endocrine therapy completion: INAVO120 phase III randomized trial additional analyses. J Clin Oncol 2024; 42(Suppl. 16): Abstr. #1003 10 Bidard F et al.: Elacestrant (oral selective estrogen receptor degrader) versus standard endocrine therapy for estrogen receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer: results from the randomized phase III EMERALD trial. J Clin Oncol 2022; 40(28): 3246-56 11 Bardia A et al.: EMERALD phase 3 trial of elacestrant versus standard of care endocrine therapy in patients with ER+/HER2- metastatic breast cancer: updated results by duration of prior CDK4/6i in metastatic setting. SABCS 2022; Abstr. #GS3-01 12 Modi S et al.: Trastuzumab deruxtecan (T-DXd) versus treatment of physician’s choice in patients with HER2-low unresectable and/or metastatic breast cancer: updated survival results of the randomized, phase III DESTINY-Breast04 study. Ann Oncol 2023; 34(Suppl. 2): S334-90 13 Curigliano G et al.: Trastuzumab deruxtecan vs physician’s choice of chemotherapy in patients with hormone receptor-positive, human epidermal growth factor receptor 2-low or HER2-ultralow metastatic breast cancer with prior endocrine therapy: primary results from DESTINY-Breast06. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #LBA1000 14 Tolaney SM et al.: Final overall survival (OS) analysis from the phase 3 TROPiCS-02 study of sacituzumab govitecan in patients with hormone receptor–positive/HER2-negative metastatic breast cancer. JClin Oncol 2023; 41(Suppl. 16): Abstr. #1003 15 Bardia A et al.: Datopotamab deruxtecan vs chemotherapy in previously-treated inoperable or metastatic hormone receptor-positive, HER2-negative breast cancer: primary results from the randomised phase III TROPION-Breast01 trial. Ann Oncol 2023; 34(Suppl. 2): S1264-5
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...