Thoraxonkologie: Die Therapiestandards wandeln sich
Autor:
Prof. Dr. med. Dr. phil. nat. Sacha Rothschild
Kantonsspital Baden
Zentrum für Onkologie & Hämatologie
E-Mail: sacha.rothschild@ksb.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Auch der diesjährige Jahreskongress der amerikanischen onkologischen Gesellschaft hat wiederum im gesamten Spektrum der Tumorerkrankungen interessante neue Erkenntnisse gebracht, die zum Teil die aktuellen Behandlungsmöglichkeiten verändern werden. Besonders im Bereich der Thoraxonkologie wurden an der diesjährigen Konferenz für die Praxis relevante Studiendaten gezeigt, mit denen sich inverschiedenen Situationen die Behandlungsstandards verändern werden.
Frühes und lokalfortgeschrittenes NSCLC
ADAURA: Osimertinib vs. Placebo
Bereits letztes Jahr habe ich an dieser Stelle die Resultate der ADAURA-Studie diskutiert, da damals die Überlebensdaten der Studie präsentiert und zeitgleich im New England Journal of Medicine publiziert wurden.1,2
In der ADAURA-Studie wurden Patient:innen mit einem vollständig resezierten nichtkleinzelligen Lungenkarzinom (NSCLC) im Stadium IB–IIIA, bei denen eine klassische EGFR-Mutation nachgewiesen wurde (Deletion Exon 19 oder Punktmutation L.858R im Exon 21), zu einer adjuvanten Therapie mit Osimertinib 80mg täglich oder Placebo für eine Dauer von drei Jahren randomisiert. Die Patient:innen konnten vorgängig eine adjuvante Chemotherapie erhalten haben, falls dies aufgrund des Tumorstadiums indiziert war.
Am diesjährigen ASCO-Jahrestreffen wurde der Stellenwert einer minimalen Resterkrankung («minimal residual disease» [MRD]) basierend auf einer Messung der ctDNA (zirkulierende zellfreie DNA) analysiert.3 Von den 682 eingeschlossenen Patient:innen konnten 220 in diese ctDNA-Analyse eingeschlossen werden. Die ctDNA wurde zum Zeitpunkt der Randomisierung, dann alle zwölf Wochen in den ersten drei Jahren, alle 24 Wochen bis zum fünften Jahr und dann einmal jährlich untersucht.
Patient:innen, bei denen unter Therapie ctDNA nachweisbar war, hatten mit grösserer Wahrscheinlichkeit ein Krankheitsrezidiv. Vom Moment des Nachweises der ctDNA bis zum Auftreten eines Rezidivs vergingen im Median 4,7 Monate. Der positive prädiktive Wert der MRD-Analyse lag bei 91% und die insgesamte Übereinstimmung der ctDNA-Analyse mit der Wahrscheinlichkeit des Auftretens eines Rezidivs lag bei 82%.
Unter Osimertinib hatten 75% der Patient:innen weder ein molekulares (ctDNA, MRD) noch ein radiologisches Rezidiv, während dies in der Placebogruppe nur auf 31% der Patient:innen zutraf. Die ctDNA-Analyse als Verlaufsparameter unter der Therapie mit Osimertinib, aber auch unter anderen Therapien, unter anderem Immuntherapien, wird momentan in vielen Studien untersucht und dürfte unser klinisches Vorgehen in absehbarer Zukunft verändern.
Innerhalb der SAKK planen wir die Studie SAKK 19/21, mit der wir die ctDNA-Analyse nicht nur zur Beurteilung des Ansprechens, sondern auch als Parameter einer frühen Therapieadaptation nutzen wollen.
Nichtresektables NSCLC: PACIFIC als Standard für fast alle Patient:innen
Beim nichtresektablen NSCLC im Stadium III ist nach erfolgter Radio-Chemotherapie eine Konsolidierung mit dem Anti-PD-L1-Inhibitor Durvalumab basierend auf den Daten der PACIFIC-Studie der Standard.4 In einer Subgruppenanalyse der Daten von 35 Patient:innen mit EGFR-mutiertem NSCLC zeigte sich weder für das progressionsfreie Überleben («progression-free survival» [PFS]) noch für das Gesamtüberleben («overall survival» [OS]) ein Vorteil für die Erhaltungstherapie mit Durvalumab.5
LAURA: Osimertinib-Erhaltung beim nichtresektablen EGFR-mutiertenNSCLC nach Radio-Chemotherapie
Die LAURA-Studie hat nun untersucht, ob bei diesen Patient:innen eine Erhaltungstherapie mit Osimertinib einen Vorteil bringen könnte.6 Die Studie wurde beim Präsidenten-Symposium am Kongress gezeigt und gleichentags im New England Journal of Medicine publiziert.7
In der Phase-III-Studie LAURA wurden 216 Patient:innen mit nichtresektablem NSCLC mit Nachweis einer EGFR-Mutation (Deletion im Exon 19 oder Punktmutation L858R im Exon 21), die innerhalb von sechs Wochen nach einer kombinierten Radio-Chemotherapie nicht progredient waren, im Verhältnis 2:1 zu einer konsolidierenden Therapie mit Osimertinib in der Standarddosierung von 80mg täglich oder Placebo randomisiert. Die Therapie wurde bis zur Krankheitsprogression oder dem Auftreten von höhergradiger Toxizität weitergeführt.
Zum Zeitpunkt der nun vorliegenden Analyse der Studie waren 56% der Patient:innen im Osimertinib-Arm noch unter Behandlung, während nur 10% der mit Placebo behandelten Patient:innen noch unter Therapie waren. Aus dem Placeboarm haben 81% der Patient:innen in der Progression eine Therapie mit Osimertinib erhalten.
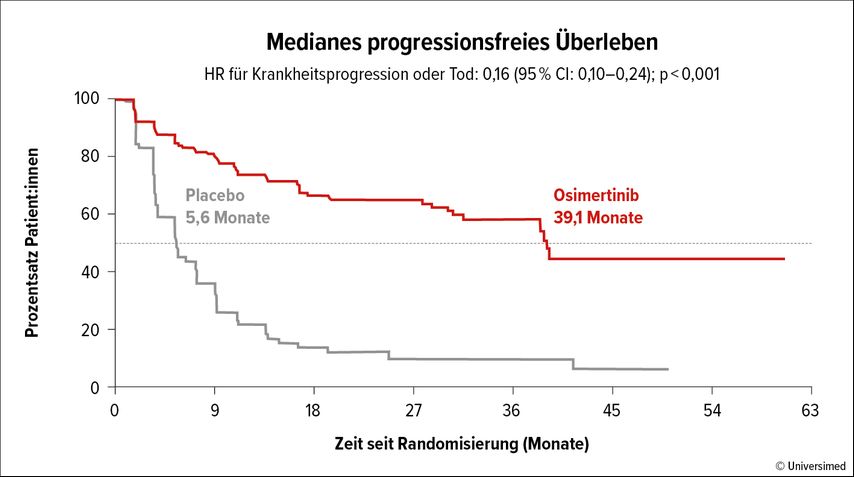
Der primäre Endpunkt der Studie war das PFS, das signifikant von 5,6 auf 39,1 Monate (Hazard-Ratio [HR]: 0,16; 95% Konfidenzintervall [CI]: 0,10–0,24; p<0,001) verlängert werden konnte (Abb. 1). Insbesondere konnte das Auftreten von Hirnmetastasen durch die Konsolidierung mit Osimertinib verhindert werden. In der Placebogruppe traten bei 29% der Patient:innen Hirnmetastasen auf, während dies unter Osimertinib nur bei 8% der Fall war.
Abb. 1: Das progressionsfreie Überleben unter Osimertinib-Erhaltungstherapie in der Studie LAURA (modifiziert nach Lu S et al.)7
Für das Gesamtüberleben wurde eine Interimsanalyse präsentiert, die keine statistische Differenz zwischen den beiden Armen zeigte. Das mediane Überleben war 54,0 Monate im Osimertinib-Arm und wurde im Placeboarm noch nicht erreicht (HR: 0,81; 95% CI: 0,42–1,56; p=0,530).
Hinsichtlich Nebenwirkungen gab es keine unerwarteten Ereignisse. Die Rate interstitieller Pneumopathien lag bei 8%, wobei die Mehrheit der Ereignisse leichtgradig war (Grad 1–2).
Zusammenfassend kann für die LAURA-Studie gesagt werden, dass die Studie positiv ist und eine deutliche Reduktion der Rezidivraten zeigt. Ein Vorteil im Gesamtüberleben konnte bisher nicht festgestellt werden. Es ist wichtig festzuhalten, dass es sich beim Stadium III um eine kurative Situation handelt und daher eine Verlängerung des Gesamtüberlebens von primärer Relevanz wäre.
Eine Verzögerung der Rezidive und insbesondere von Rezidiven im Hirn kann für Patient:innen jedoch auch einen Nutzen darstellen, der unter Berücksichtigung von Nebenwirkungen und auch den Kosten der zeitlich nicht befristeten und bis zur Progression durchgeführten Therapie kritisch evaluiert werden sollte.
Metastasiertes NSCLC
ALK-Translokationen treten bei 3–5% der Patient:innen mit NSCLC auf und sind gehäuft bei Adenokarzinomen, jüngeren Patient:innen und Nie-Raucher:innen.8
In mehreren Studien konnte nachgewiesen werden, dass eine spezifische Hemmung von ALK mit dem Tyrosinkinase-Inhibitor Crizotinib einer konventionellen Chemotherapie gegenüber überlegen ist.9,10 Mittlerweile konnte in verschiedenen Studien auch eine Überlegenheit von neueren, spezifischeren ALK-Inhibitoren gegenüber Crizotinib demonstriert werden. In der Schweiz sind für die Erstlinienbehandlung des metastasierten ALK-positiven NSCLC Alectinib, Brigatinib und Lorlatinib zugelassen.
CROWN: Lorlatinib vs. Crizotinib
In der randomisierten Phase-III-Studie CROWN wurden 296 Patient:innen mit ALK-positivem NSCLC ohne Vorbehandlung zu Lorlatinib oder Crizotinib randomisiert.11 Schon in der ersten Analyse konnte eine Verlängerung des PFS als primärer Endpunkt gezeigt werden. Nun wurden am ASCO-Kongress die Daten nach einer Nachbeobachtungszeit von fünf Jahren präsentiert12 und zeitgleich im Journal of Clinical Oncology publiziert.13
Nach einer medianen Nachbeobachtungszeit von 60,2 Monaten war das mediane PFS bei mit Lorlatinib behandelten Patient:innen noch nicht erreicht und lag bei 9,1 Monaten mit Crizotinib (HR: 0,19; 95% CI: 0,13–0,27). Der eindrückliche Vorteil von Lorlatinib zeigte sich in allen Subgruppen, insbesondere auch bei Patient:innen mit Hirnmetastasen, die auch in die Studie eingeschlossen werden konnten, vorausgesetzt die Metastasen waren asymptomatisch.
Das Auftreten von zerebralen Metastasen ist eine der klinischen Herausforderungen bei Patient:innen mit ALK-positivem NSCLC. Mit Lorlatinib konnte die Zeit bis zur intrakraniellen Progression signifikant verlängert werden (mediane Zeit: nicht erreicht vs. 16,4 Monate; HR: 0,06%; 95% CI: 0,03–0,12). Beim Toxizitätsprofil von Lorlatinib sind insbesondere Veränderungen im Stoffwechsel (Hypertriglyzeridämie, Hypercholesterinämie), neurologische Nebenwirkungen (periphere Neuropathie, neurokognitive Veränderungen) sowie Ödeme zu berücksichtigen. Bei rund einem Viertel der Patient:innen ist eine Dosisreduktion notwendig. Die CROWN-Studie zeigte auch, dass Dosisanpassungen nicht mit einer Verringerung der Wirksamkeit einhergehen. Trotz langer Nachbeobachtungszeit sind die Daten für das Gesamtüberleben noch nicht reif, sodass diese Analyse noch ausstehend ist.
Mit diesen eindrücklichen Langzeitdaten aus der CROWN-Studie wird Lorlatinib zur präferierten Therapie in der ersten Linie beim metastasierten ALK-positiven NSCLC. Auch wenn es keinen direkten Vergleich zu den anderen neueren ALK-Inhibitoren gibt, suggeriert der Vergleich der Daten aus den verschiedenen Studien eine Überlegenheit von Lorlatinib, wobei es hier das unterschiedliche Nebenwirkungsspektrum zu beachten gilt, das oben kurz diskutiert wurde.
PALOMA-3: Amivantamab s.c. vs. i.v.
Die Therapie des EGFR-mutierten, metastasierten NSCLC ist im Wandel. Der bispezifische, gegen EGFR und MET gerichtete Antikörper Amivantamab hat beim EGFR-mutierten, metastasierten NSCLC interessante Resultate gezeigt.
Am ASCO-Jahrestreffen wurden die Daten der Studie PALOMA-3 präsentiert, in der bei Patient:innen mit metastasiertem, refraktärem EGFR-mutiertem NSCLC die subkutane Gabe von Amivantamab mit der intravenösen Gabe verglichen wurde.14 Die subkutane Gabe war der intravenösen Applikation nicht unterlegen und war besser verträglich.
MARIPOSA: Amivantamab im Vergleich
In der dreiarmigen Studie MARIPOSA wurde Amivantamab in Kombination mit dem EGFR-Tyrosinkinase-Inhibitor (TKI) Lazertinib gegenüber Osimertinib und gegenüber Lazertinib alleine verglichen.15,16
In die Studie wurden 1074 Patient:innen eingeschlossen, die 2:2:1 randomisiert wurden. Der primäre Endpunkt war der Vergleich des PFS zwischen Amivantamab+Lazertinib gegenüber Osimertinib. Der primäre Endpunkt wurde erreicht.
Das mediane PFS wurde von 16,6 auf 23,7 Monate verlängert (HR: 0,70; 95% CI: 0,58–0,85; p<0,001). Die Wirksamkeit war unabhängig vom Vorliegen von Hirn- oder Lebermetastasen und war bei Patient:innen mit einer prognostisch ungünstigen Komutation in TP53 noch grösser.
Patient:innen mit atypischen EGFR-Mutationen haben eine schlechtere Prognose als diejenigen mit den klassischen Mutationen in Exon 19 und Exon 21.17 Die klassischen EGFR-TKI zeigen nur eine eingeschränkte Aktivität.
CHRYSALIS-2: Amivantamab+Lazertinib
In der Studie CHRYSALIS-2 wurde die Aktivität von Amivantamab in Kombination mit Lazertinib bei Patient:innen mit metastasiertem NSCLC mit Vorliegen einer atypischen EGFR-Mutation untersucht.18 Es wurden insgesamt 105 Patient:innen in die Studie eingeschlossen, von denen 49 therapienaiv waren.
Insgesamt zeigte sich eine Ansprechrate von 52%, die bei Patient:innen ohne Vorbehandlung bei 57% und bei vorbehandelten Patient:innen bei 48% lag. Die Dauer des Ansprechens war 21 bzw. 17 Monate und das mediane PFS wurde mit 19,5 Monaten in der Erstlinientherapie und mit 7,8 Monaten in späteren Therapielinien beziffert.
Amivantamab verursacht Infusionsreaktionen, kutane Toxizität sowie Ödeme und eine Hypoalbuminämie als relevanteste Nebenwirkungen.
WUKONG1: Sunvozertinib 20 vs. 30mg
Mit dem selektiven EGFR-TKI Sunvozertinib wurde eine andere Substanz vorgestellt, die bei Vorliegen von EGFR-Exon-20-Insertionsmutationen eine Aktivität hat.19
In der einarmigen Phase-II-Studie wurden 107 Patient:innen mit metastasiertem NSCLC und Vorliegen einer EGFR-Exon-20-Insertionsmutation eingeschlossen und mit Sunvozertinib in zwei unterschiedlichen Dosierungen behandelt (20mg oder 30mg).
Es zeigten sich eine Ansprechrate von 53,3% und eine intrazerebrale Ansprechrate von 44,9%. Sunvozertinib hatte ein gutes Verträglichkeitsprofil, wobei Diarrhö die häufigste Nebenwirkung war.
KRYSTAL-12: 2L-Adagrasib vs. Docetaxel
KRAS-Mutationen sind die häufigsten molekularen Veränderungen beim NSCLC und kommen bei rund 30% der Patient:innen in westlichen Ländern vor. Die KRAS-G12C-Mutation ist beim NSCLC die häufigste KRAS-Alteration. Verschiedene KRAS-G12C-spezifische Inhibitoren werden zurzeit untersucht.
Einer dieser Inhibitoren ist Adagrasib, der in der randomisierten Phase-III-Studie KRYSTAL-12 in der zweiten Therapielinie gegen Docetaxel verglichen wurde.20 Es wurden 453 Patient:innen mit metastasiertem NSCLC mit Nachweis einer KRAS-G12C-Mutation und einer Vorbehandlung mit einer platinbasierten Chemotherapie und einem PD-(L)1-Inhibitor eingeschlossen und 2:1 randomisiert.
Der primäre Endpunkt war das PFS, es konnte signifikant verlängert werden. Das mediane PFS war 5,5 respektive 3,8 Monate (HR: 0,58; 95% CI: 0,45–0,76; p<0,0001). Auch die Wahrscheinlichkeit eines Ansprechens konnte verbessert werden (32% vs. 9%), insbesondere auch die Rate des intrazerebralen Ansprechens bei Vorliegen von Hirnmetastasen (24% vs. 11%). Die Analyse der Daten zum Gesamtüberleben ist noch ausstehend.
Olomorasib+Pembrolizumab
Verschiedene weitere spezifische KRAS-G12C-Inhibitoren werden in unterschiedlichen klinischen Studien als Monotherapie oder in Kombination mit Chemo- oder Immuntherapie untersucht.
Für den Inhibitor Olomorasib wurden Daten zur Kombinationsbehandlung mit dem Anti-PD-1-Antikörper Pembrolizumab präsentiert.21
In dieser Phase-I-Studie zeigten sich eine insgesamt gute Verträglichkeit der Therapie und eine Ansprechrate von 77% bei vorher unbehandelten Patient:innen und von 40% bei Patient:innen, die vorgängig schon eine Behandlung erhalten haben. Die überwiegende Mehrheit dieser Patient:innen hatte eine Vorbehandlung mit einer Immuntherapie erhalten und knapp die Hälfte der Patient:innen auch einen anderen KRAS-G12C-Inhibitor in einer früheren Therapielinie.
Kleinzelliges Bronchialkarzinom
Beim nichtmetastasierten kleinzelligen Bronchialkarzinom («limited disease small cell lung cancer» [LD-SCLC]) ist die kombinierte Radio-Chemotherapie mit Cisplatin/Etoposid die Standardtherapie. Beim metastasierten («extensive disease» [ED]) SCLC hat sich die kombinierte Chemo-Immuntherapie mit Platin/Etoposid in Kombination mit Atezolizumab oder Durvalumab basierend auf zwei randomisierten Phase-III-Studien als Standard etabliert.22,23
BEAT-SC: Bevacizumab in Kombination
Die Studie BEAT-SC untersuchte, ob die Therapie mit Bevacizumab in Kombination mit Platin/Etoposid und Atezolizumab die Prognose zusätzlich verbessern kann.24
Das PFS als primärer Endpunkt wurde signifikant um 1,3 Monate verlängert (medianes PFS: 4,4 vs. 5,7 Monate; HR: 0,70; 95% CI: 0,54–0,90; p=0,0060). Das Gesamtüberleben war jedoch im Kontrollarm numerisch besser (medianes OS: 16,6 vs. 13,0; HR: 1,22; 95% CI: 0,89–1,67; p=0,2212). Trotz kleinem, aber signifikantem Nutzen bei der progressionsfreien Zeit kann diese Kombination nicht empfohlen werden.
ADRIATIC: Durvalumab beim LD-SCLC
Die ADRIATIC-Studie untersuchte den Stellenwert einer Immuntherapie mit dem Anti-PD-L1-Antikörper Durvalumab beim LD-SCLC.25 In dieser Studie wurden 730 Patient:innen mit LD-SCLC, die nach kombinierter Radio-Chemotherapie nicht progredient waren, zu Durvalumab 1500mg alle vier Wochen oder Placebo randomisiert. Die Therapie wurde über insgesamt maximal zwei Jahre oder bis zur Progression fortgeführt. Die primären Endpunkte waren PFS und OS.
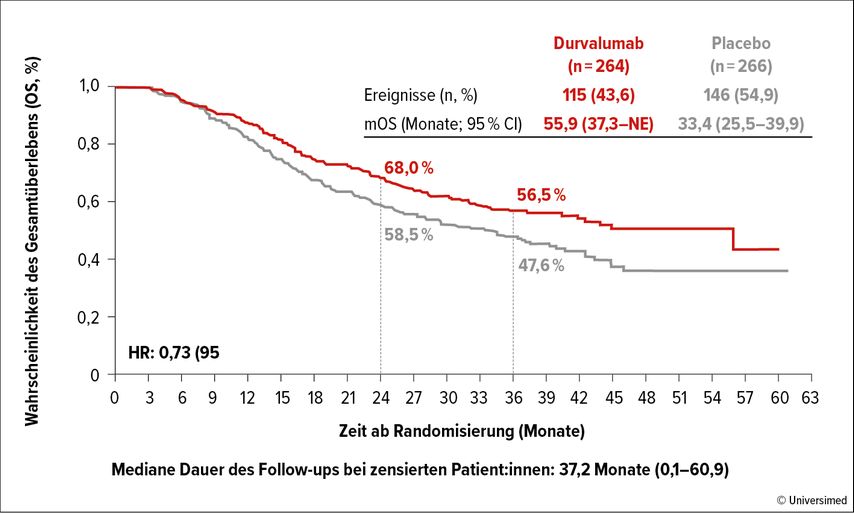
Das mediane Gesamtüberleben konnte durch eine Erhaltungstherapie mit Durvalumab von 33,4 auf 55,9 Monate verlängert werden (Abb. 2; HR: 0,73; 95% CI: 0,57–0,93; p=0,0104). Auch das PFS wurde signifikant verlängert.
Die Rate an höhergradiger Toxizität unter Durvalumab lag bei 24,4% und war 24,2% im Placeboarm. 16,4% der Patient:innen unter Durvalumab haben die Therapie aufgrund von Nebenwirkungen abgebrochen. Diese Rate lag bei 10,6% im Placeboarm.
Die Erhaltungstherapie mit Durvalumab führt somit zu einer bedeutungsvollen Verlängerung des Gesamtüberlebens und wird sich als neuer Standard in der Therapie des LD-SCLC etablieren.
Mesotheliom
Beim fortgeschrittenen Pleuramesotheliom ist die Chemotherapie in Kombination mit Bevacizumab basierend auf der MAPS-Studie die etablierte Erstlinientherapie.26Die Studie CheckMate 743 verglich eine kombinierte Immuntherapie mit Ipilimumab/Nivolumab mit einer Chemotherapie mit Platin/Pemetrexed27 und konnte eine Verlängerung des Gesamtüberlebens mit der Immuntherapie nachweisen.
In einer Subgruppenanalyse zeigte sich, dass der Vorteil auf Patient:innen mit nichtepitheloider Histologie beschränkt war. Der Nutzen einer Immuntherapie bei nichtepitheloider Histologie konnte in zahlreichen anderen Studien bestätigt werden.
BEAT-meso: epitheloid/nichtepitheloid
In der nun präsentierten Studie BEAT-meso der ETOP wurden Patient:innen mit fortgeschrittenem Pleuramesotheliom ohne Vorbehandlung zu einer Chemotherapie mit Carboplatin/Pemetrexed in Kombination mit Bevacizumab oder der gleichen Therapie mit zusätzlicher Gabe des Anti-PD-L1-Antikörpers Atezolizumab randomisiert.28 Der primäre Endpunkt der Studie war das Gesamtüberleben.
Die Gesamtüberlebensrate konnte nicht verbessert werden und lag nach zwei Jahren bei 38% respektive 40% (HR: 0,84; 95% CI: 0,66–1,06; p=0,14). Die Analyse war für den histologischen Subtyp stratifiziert (epitheloid vs. nichtepitheloid). Bei nichtepitheloider Histologie zeigte sich wieder ein deutlicher und signifikanter Nutzen der Immuntherapie. Die Überlebensrate nach zwei Jahren wurde von 14% auf 29% verdoppelt (HR: 0,50; 0,32–0,78; p=0,0022). Die Expression von PD-L1 war für den Nutzen der Immuntherapie nicht prädiktiv. Das PFS konnte durch die Kombination mit der Immuntherapie in der Gesamtpopulation signifikant verlängert werden (HR: 0,72; 95% CI: 0,59–0,89; p=0,0020). Die kombinierte Therapie mit Chemotherapie, Anti-VEGF-Antikörper und Immuncheckpoint-Inhibitor zeigte eine erhöhte Toxizität mit auch mehr therapieassoziierten Todesfällen. Somit wird sich diese Vierfachtherapie nicht als neuer Standard etablieren. Die Studie unterstreicht jedoch den Nutzen einer Immuntherapie beim nichtepitheloiden Pleuramesotheliom.
Literatur:
1 Herbst RS et al.: Overall survival analysis from the ADAURA trial of adjuvant osimertinib in patients with resected EGFR-mutated (EGFRm) stage IB–IIIA non-small cell lung cancer (NSCLC). J Clin Oncol 2023; 41(Suppl. 17): Abstr. #LBA3 2 Tsuboi M et al.: Overall survival with osimertinib in resected EGFR-mutated NSCLC. N Engl J Med 2023; 389(2): 137-47 3 John T et al.: Molecular residual disease (MRD) analysis from the ADAURA trial of adjuvant (adj) osimertinib in patients (pts) with resected EGFR-mutated (EGFRm) stage IB–IIIA non-small cell lung cancer (NSCLC). J Clin Oncol 2024; 42(Suppl. 16): Abstr. #8005 4 Spigel DR et al.: Five-year survival outcomes from the PACIFIC trial: durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. J Clin Oncol 2022; 40(12): 1301-11 5 Naidoo J et al.: Brief report: durvalumab after chemoradiotherapy in unresectable stage III EGFR-mutant NSCLC: a post hoc subgroup analysis from PACIFIC. J Thorac Oncol 2023; 18(5): 657-63 6 Ramalingam SS et al.: Osimertinib (osi) after definitive chemoradiotherapy (CRT) in patients (pts) with unresectable stage (stg) III epidermal growth factor receptor-mutated (EGFRm) NSCLC: Primary results of the phase 3 LAURA study. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #LBA4 7 Lu S et al.: Osimertinib after chemoradiotherapy in stage III EGFR-mutated NSCLC. N Engl J Med 2024; 391(7): 585-97 8 Koivunen JP et al.: EML4-ALK fusion gene and efficacy of an ALK kinase inhibitor in lung cancer. Clin Cancer Res 2008; 14(13): 4275-83 9 Shaw AT et al.: Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med 2013; 368(25): 2385-94 10 Solomon BJ et al.: First-line crizotinib versus chemotherapy in ALK-positive lung cancer. NEngl J Med 2014; 371(23): 2167-7 11 Shaw AT et al.: First-line lorlatinib or crizotinib in advanced ALK-positive lung cancer. N Engl J Med 2020; 383(21): 2018-29 12 Solomon BJ et al.: Lorlatinib vs crizotinib in treatment-naïve patients with advanced ALK+ non-small cell lung cancer: 5-year progression-free survival and safety from the CROWN study. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #80030 13 Solomon BJ et al.: Lorlatinib versus crizotinib in patients with advanced ALK-positive non-small cell lung cancer: 5-year outcomes from the phase III CROWN study. J Clin Oncol 2024; doi.org/10.1200/JCO.24.00581 14 Leighl NB et al.: Subcutaneous amivantamab vs intravenous amivantamab, both in combination with lazertinib, in refractory EGFR-mutated, advanced non-small cell lung cancer (NSCLC): Primary results, including overall survival (OS), from the global, phase 3, randomized controlled PALOMA-3 trial. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #LBA8505 15 Felip E et al.: Amivantamab plus lazertinib vs osimertinib in first-line EGFR-mutant advanced non-small cell lung cancer (NSCLC) with biomarkers of high-risk disease: a secondary analysis from the phase 3 MARIPOSA study. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #8005 16 Cho BC et al.: Amivantamab plus lazertinib in previously untreated EGFR-mutated advanced NSCLC. NEngl J Med 2024; doi:10.1056/NEJMoa2403614 17 Oxnard GR et al.: Natural history and molecular characteristics of lung cancers harboring EGFR exon 20 insertions. J Thorac Oncol 2013; 8(2): 179-84 18 Cho BC et al.: Amivantamab plus lazertinib in atypical EGFR-mutated advanced non-small cell lung cancer (NSCLC): results from CHRYSALIS-2. J Clin Oncol 2024; 42(Suppl. 16): Abstr. #8516 19 Yang JCH et al.: A multinational pivotal study of sunvozertinib in platinum pretreated non-small cell lung cancer with EGFR exon 20 insertion mutations: primary analysis of WU-KONG1 study. J Clin Oncol 2024; 42(Suppl. 16): Abstr. #8513 20 Mok TSK et al.: KRYSTAL-12: phase 3 study of adagrasib versus docetaxel in patients with previously treated advanced/metastatic non-small cell lung cancer (NSCLC) harboring a KRASG12C mutation. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #LBA8509 21 Burns TF et al.: Efficacy and safety of olomorasib (LY3537982), asecond-generation KRAS G12C inhibitor (G12Ci), in combination with pembrolizumab in patients with KRAS G12C-mutant advanced NSCLC. J Clin Oncol 2024; 42(Suppl. 16): Abstr. #LBA8510 22 Horn L et al.: First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med 2018; 379(23): 2220-9 23 Paz-Ares L et al.: Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomised, controlled, open-label, phase 3 trial. Lancet 2019; 394(10212): 1929-39 24 Ohe Y et al.: BEAT-SC: a randomized phase III study of bevacizumab or Placebo in combination with atezolizumab and platinum-based chemotherapy in patients with extensive-stage small cell lung cancer (ES-SCLC). JClin Oncol 2024; 42(Suppl. 16): Abstr. #8001 25 Spigel DR et al.: ADRIATIC: durvalumab (D) as consolidation treatment (tx) for patients (pts) with limited-stage small-cell lung cancer (LS-SCLC). J Clin Oncol 2024; 42(Suppl. 17): Abstr. #LBA5 26 Zalcman G et al.: Bevacizumab for newly diagnosed pleural mesothelioma in the Mesothelioma Avastin Cisplatin Pemetrexed Study (MAPS): a randomised, controlled, open-label, phase 3 trial. Lancet 2016; 387(10026): 1405-14 27 Baas P et al.: First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial. Lancet 2021; 397(10272): 375-86 28 Popat S et al.: BEAT-meso: a randomized phase III study of bevacizumab (B) and standard chemotherapy (C) with or without atezolizumab (A), as first-line treatment (TX) for advanced pleural mesothelioma (PM) — results from the ETOP 13-18 trial. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #LBA8002
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...