Therapiestandards: aktuelle Entwicklungen
Autor:innen:
Dr. med. Alexander Mang
Dr. med. Annegret Meyer-Hari
Dr. med. Martin Fehr
Klinik für Medizinische Onkologie und Hämatologie, Kantonsspital St. Gallen
Die Autor:innen haben zu gleichen Teilen beigetragen.
Korrespondenz:
E-Mail: martin.fehr@h-och.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Therapiestandards beim Mantelzelllymphom (MCL) sind aktuell im Wandel: Vor Kurzem erfolgten Zulassungen von Inhibitoren der Bruton-Tyrosinkinase (BTKi) in Kombination mit Chemoimmuntherapie für die Erstlinientherapie; damit verbunden ergibt sich bei Einsatz von Ibrutinib zusammen mit einer intensiven Induktionstherapie und entsprechender Erhaltungstherapie kein zusätzlicher Benefit für eine Hochdosistherapie mit autologer Stammzelltransplantation (ASCT), sodass diese nicht mehr Teil der Standardtherapie ist. Inder nachfolgenden Übersicht werden zudem weitere potenziell praxisrelevante und vielversprechende Entwicklungen in der Rezidivtherapie beleuchtet. Für eine vollständige Übersicht und detaillierte Darstellung sei zudem auch auf die kürzlich publizierten EHA-EU-MCL-Network-Guidelines verwiesen.1
Erstlinientherapie
Der bisher etablierte Therapiealgorithmus der fortgeschrittenen Stadien sah eine Patient:inneneinteilung nach Transplantationsfähigkeit vor, die sich sehr am Patient:innenalter orientierte. Der Behandlungsstandard der jüngeren Patient:innenpopulation bis zum Alter von 65 Jahren umfasste eine Rituximab- und Cytarabin-haltige Chemoimmuntherapie als Induktion, gefolgt von einer Hochdosischemotherapie mit autologer Stammzelltransplantation (ASCT). Daran anschliessend erfolgte eine dreijährige Erhaltungstherapie mit Rituximab.2,3
TRIANGLE: Ibrutinib-Kombination
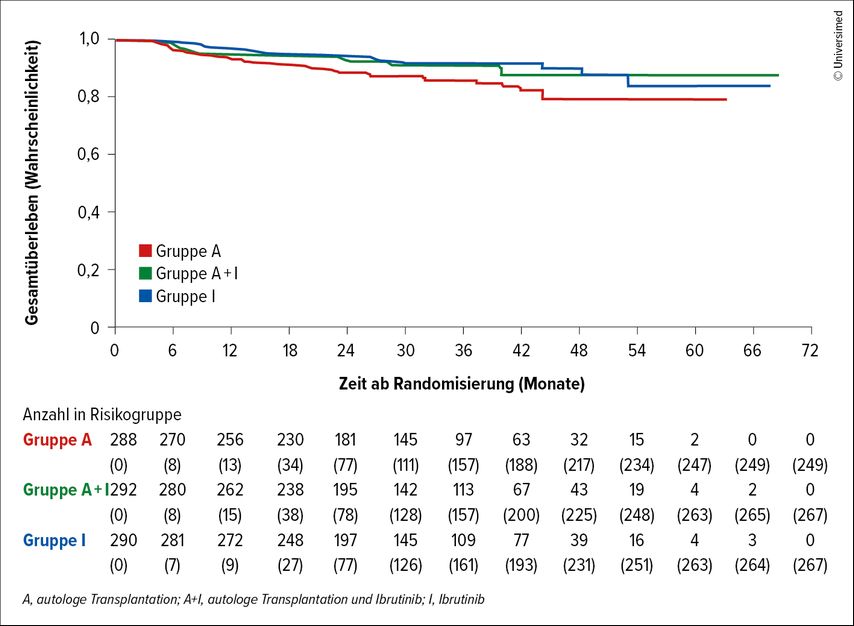
Dieses Konzept wird durch die Resultate der TRIANGLE-Studie verändert.4 Die Studie randomisierte transplantationsfähige Patient:innen in drei verschiedene Behandlungsarme: Immunchemotherapie als Induktion gefolgt von autologer Stammzelltransplantation, Immunchemotherapie+Ibrutinib gefolgt von ASCT und zweijähriger Ibrutinib-Erhaltungstherapie oder Immunchemotherapie+Ibrutinib ohne ASCT, gefolgt von zweijähriger Ibrutinib-Erhaltungstherapie. Die Rituximab-Erhaltungstherapie war zur Zeit der Konzeption der TRIANGLE-Studie noch kein Therapiestandard, somit auch nicht Teil des Studienprotokolls und wurde je nach nationalem Standard bei der Mehrzahl der Patient:innen in allen drei Armen gleich häufig durchgeführt. In beiden Ibrutinib-haltigen Behandlungsarmen zeigten sich statistisch signifikante und relevante Verlängerungen des «failure-free survival» (FFS) und des Gesamtüberlebens (OS) verglichen mit der Standard-Immunchemotherapie gefolgt von ASCT: Die 3-Jahres-FFS-Rate lag bei 88% bzw. 86% vs. 72% und die 3-Jahres-Gesamtüberlebensrate bei 91% bzw. 92% vs. 86% (Abb.1).4 Für die frühere Standardtherapie mit ASCT (ohne Ibrutinib) konnte im Vergleich zum Therapiearm mit Ibrutinib ohne ASCT keine Überlegenheit nachgewiesen werden.4
Diese Ergebnisse führten dazu, dass die Hinzunahme von Ibrutinib zur Induktions-Immunchemotherapie gefolgt von einer Erhaltungstherapie mit Ibrutinib und Rituximab mittlerweile als neuer Standard bei jüngeren Patient:innen mit MCL angesehen wird (entsprechend erfolgte die Zulassung von Ibrutinib in der Erstlinientherapie in der EU). Eine Hochdosischemotherapie mit ASCT ist somit für Patient:innen, die Ibrutinib in der Induktions- und Erhaltungstherapie bekommen, nicht mehr Teil der Standardtherapie.
Die Studien ECHO und SHINE
Im älteren, nicht für intensive Induktionschemotherapie qualifizierenden Patient:innenkollektiv (vormals «nichttransplantationsfähig») wurde in zwei prospektiven, randomisierten, placebokontrollierten Phase-III-Studien – ECHO und SHINE – die Kombination von BTK-Inhibitoren mit dem etablierten Erstlinienregime Rituximab/Bendamustin (R/B) und Rituximab-Erhaltung geprüft.5,6
ECHO: R/B+Acalabrutinib
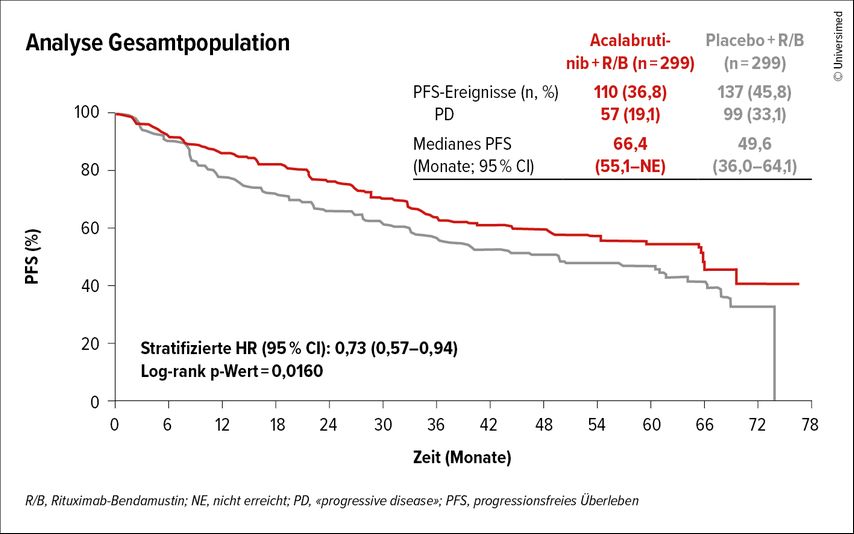
Die Hinzunahme von Acalabrutinib führte in der ECHO-Studie zu einer signifikanten Verlängerung des progressionfreien Überlebens (PFS) verglichen mit dem Kontrollarm (R/B und Placebo) mit einer HR von 0,73 (95% CI: 0,57–0,94) (Abb.2). Dieser Benefit erstreckte sich auch über Hochrisiko-Subgruppen (z.B. mit Bulk, Ki-67 ≥30%, blastoide Morphologie). Basierend auf den Resultaten der ECHO-Studie erfolgte die Zulassung durch die EMA und durch Swissmedic für Acalabrutinib in Kombination mit R/B-Induktion und R-Erhaltung.
Abb. 2: Die Hinzunahme von Acalabrutinib führte in der ECHO-Studie zu einer signifikanten Verlängerung des progressionsfreien Überlebens vs. den Kontrollarm (modifiziert nach Wang M et al.)5
SHINE: R/B+Ibrutinib
Die ähnlich konzipierte SHINE-Studie untersuchte die Hinzunahme von Ibrutinib zu R/B, wobei mit einer signifikanten Verlängerung des PFS ebenso der primäre Endpunkt erreicht wurde.6
Einschränkend sei erwähnt, dass für Ibrutinib in Kombination mit R/B aus einer Reihe von Gründen keine Zulassung besteht; generell sollte bei älteren Patient:innen mit MCL der Einsatz der BTK-Inhibitoren-haltigen Dreifachkombination unter Berücksichtigung der klinischen Gesamtsituation sowie der Abwägung von potenziellem Benefit, individuellen Therapiezielen und Toxizitätsrisiken erfolgen.
ENRICH:chemotherapiefreie Erstlinie
Aktuell werden verschiedene Studien durchgeführt, mit dem Ziel, chemotherapiefreie Erstlinienoptionen insbesondere bei älteren Patient:innen zu etablieren. Von der ENRICH-Studie liegen bereits Resultate vor. In dieser Studie wurden Patient:innen ≥60 Jahre mit unbehandeltem MCL (Stadium II–IV) in zwei Behandlungsarme randomisiert: Ibrutinib plus Rituximab gefolgt von Ibrutinib bis zu Progression oder inakzeptabler Toxizität vs. Rituximab plus Chemotherapie (R/B oder R-CHOP). In beiden Armen erhielten die Patient:innen eine Rituximab-Erhaltungstherapie (12 Zyklen, Zyklusintervall 8 Wochen).
Dabei bot die Kombination von Ibrutinib und Rituximab ein insgesamt signifikant längeres PFS verglichen mit der Kombination von Rituximab und Chemotherapie bei geringerer Hämatotoxizität.7 Allerdings war gemäss Subgruppenanalyse das PFS zwischen den mit Rituximab/Ibrutinib und mit Rituximab/Bendamustin behandelten Patient:innen nicht signifikant unterschiedlich. Auch sind die Daten der ENRICH-Studie nur begrenzt auf Patient:innen mit Hochrisiko-Merkmalen (hoher MIPI-Score, blastoide Morphologie, TP53-Mutation oder p53-Überexpression) übertragbar.
Therapie im Rezidiv
Generell sollten bei jeder Rezidivsituation Patient:innen-, Krankheits- und therapiespezifische Faktoren evaluiert (z.B. Komorbiditäten, Allgemeinzustand; Proliferationsindex, TP53-Aberration, blastoide Histologie; Ansprechen und Toxizität der Vortherapien) und anhand von diesen die Therapiewahl und individuellen Therapieziele besprochen werden.1
Zudem soll bei der Behandlung von Patient:innen im ersten Rezidiv des Mantelzelllymphoms unterschieden werden zwischen BTKi-naiven Patient:innen und solchen, die schon BTKi-vorexponiert waren.1
Rezidiv nach Chemoimmuntherapie
Für die Behandlung von BTKi-naiven Patient:innen sind Ibrutinib und Acalabrutinib als Monotherapie zugelassen und die Therapie wird gewöhnlich bis zur Krankheitsprogression oder bis zu unakzeptabler Toxizität weitergeführt. Im retrospektiven Vergleich mit Chemoimmuntherapien sind Vorteile bezüglich Verträglichkeit und bei Patient:innen mit frühem Rezidiv nach Chemoimmuntherapie (<2 Jahren) ein längeres PFS für die Therapie mit Ibrutinib belegt.8
Für den direkten Vergleich von Ibrutinib und Acalabrutinib gibt es bei Patient:innen mit rezidiviertem/refraktärem MCL keine Daten, jedoch bei Patient:innen mit chronischer lymphatischer Leukämie (CLL), bei denen im prospektiv randomisierten Vergleich ein günstigeres Nebenwirkungsprofil für Acalabrutinib demonstriert wurde.9,10
Das Ansprechen auf kovalente BTKi (cBTKi) ist unterschiedlich: Während bei Patient:innen, die eine komplette Remission (CR) erreichen, diese oft über einen langen Zeitraum anhalten kann, spricht die Erkrankung bei etwa einem Drittel der Patient:innen nicht auf die Therapie an.1 Mittels «2nd line BTKi-MIPI»-Score, in den zusätzlich zu den bekannten MIPI-Faktoren auch der Proliferationsindex Ki-67 und die rezidivfreie Zeit einfliessen, kann das Risiko für eine frühe Progression unter cBTKi abgeschätzt werden.11
Für Patient:innen mit einem hohen Risiko für eine frühe Progression, die für eine nachfolgende CAR-T-Zell-Therapie infrage kommen, besteht die Empfehlung für engmaschiges Monitoring und gegebenenfalls frühzeitige Kontaktaufnahme mit einem CAR-T-Zell-Zentrum.12
SYMPATICO: Ibrutinib+Venetoclax
Aktuell gibt es verschiedene Ansätze, durch eine Kombinationstherapie die Effektivität der BTKi-basierten Rezidivtherapie zu verbessern. In der randomisierten, doppelblinden Phase-III-Studie SYMPATICO wurde die Kombination von Ibrutinib und Venetoclax gegenüber Ibrutinib und Placebo verglichen.13 Die Patient:innen im experimentellen Arm erhielten Ibrutinib bis zur Progression und Venetoclax während der ersten 24 Monate.
Die Kombinationstherapie war hinsichtlich der progressionsfreien Zeit und der Ansprechraten gegenüber der Ibrutinib-Monotherapie überlegen, allerdings bei vermehrter Toxizität. Bemerkenswerterweise profitierten auch Patient:innen mit TP53-Mutation als Hochrisikocharakteristikum von der Kombination.13
SAKK 36/13: Ibrutinib+Bortezomib
In der Phase-I/II-Studie SAKK 36/13, die in mehreren Zentren in der Schweiz und einigen deutschen und italienischen Zentren durchgeführt wurde, wurde die Kombination von Ibrutinib mit dem Proteasominhibitor Bortezomib evaluiert.14 Damit konnte eine Gesamtansprechrate von 87% erreicht werden, wobei 75% der Patient:innen ein oder mehrere Hochrisikomerkmale aufwiesen (hohe Proliferationsrate, TP53-Aberration, blastoide/pleomorphe Histologie).14
Rezidiv nach cBTKi-Expositionoder Progression unter cBTKi
Bei einer Progression unter cBTKi-Therapie waren die Möglichkeiten bis vor Kurzem limitiert und das Überleben mit konventionellen Therapien oftmals kurz (median acht Monate). Dank neuer Optionen besteht die Aussicht auf Verbesserungen in dieser herausfordernden Situation.
Brexucabtagen autoleucel
Mit der CD19-CAR-T-Zell-Therapie Brexucabtagen autoleucel wurden in einer Phase-II-Studie eine Ansprechrate von 91% und eine mediane Gesamtüberlebenszeit von knapp 47 Monaten erreicht.15
BRUIN: Pirtobrutinib
Eine weitere Option stellt die Therapie mit dem nichtkovalenten BTKi (ncBTKi) Pirtobrutinib dar.16 In der MCL-Kohorte der Phase-II-Studie BRUIN haben 49% der Patient:innen mit Progression unter cBTKi-Vorbehandlung angesprochen bei gleichzeitig guter Verträglichkeit der Therapie. So kann Pirtobrutinib auch bei Patient:innen eingesetzt werden, bei denen eine CAR-T-Zell-Therapie nicht infrage kommt oder nicht unmittelbar möglich ist.
Aus Real-World-Daten des EMCL-Registers geht hervor, dass Pirtobrutinib in rund 50% der Fälle als überbrückende Therapie bis zur CAR-T-Zell-Therapie eingesetzt wird.17
Sowohl für Brexucabtagen autoleucel als auch für Pirtobrutinib bestehen sowohl in der EU als auch in der Schweiz entsprechende Zulassungen, die sich jedoch in den Details voneinander unterscheiden.
CD3xCD20-Antikörper
Wie bei anderen Lymphomentitäten wird auch beim MCL der Einsatz von bispezifischen CD3xCD20-Antikörpern weiter entwickelt, mit ebenfalls vielversprechenden Resultaten bezüglich der klinischen Aktivität; allerdings sollte nach aktuellem Kenntnisstand beim Einsatz von bispezifischen CD3xCD20-Antikörpern beim MCL besonderes Augenmerk der Vorbeugung und Behandlung des recht häufig auftretenden und teils sehr ausgeprägten Zytokinfreisetzungssyndroms (CRS) geschenkt werden.18
Literatur:
1 Jerkeman M et al.: EHA–EU MCL network guidelines for diagnosis and treatment of mantle cell lymphoma. Hemasphere 2025; 9(10): e70233 2 Wilson MR et al.: How I manage mantle cell lymphoma: indolent vs. aggressive disease. Br J Haematol 2023; 201(2): 185-98 3 Hermine O et al.: High-dose cytarabine and autologous stem-cell transplantation in mantle cell lymphoma: long-term follow-up of the randomized Mantle Cell Lymphoma Younger Trial of the European Mantle Cell Lymphoma Network. JClin Oncol 2023; 41(3): 479-84 4 Dreyling M et al.: Ibrutinib combined with immunochemotherapy with or without autologous stem-cell transplantation vs. immunochemotherapy and autologous stem-cell transplantation in previously untreated patients with mantle cell lymphoma (TRIANGLE): a three-arm, randomised, open-label, phase 3 superiority trial of the European Mantle Cell Lymphoma Network. Lancet 2024; 403(10441): 2293-306 5 Wang M et al.: Acalabrutinib plus bendamustine and rituximab in untreated mantle cell lymphoma: results from the phase 3, double-blind,placebo-controlled ECHO trial. EHA24 2024; Abstr. #LB3439 6 Wang ML et al.: Ibrutinib plus bendamustine and rituximab in untreated mantle-cell lymphoma. N Engl J Med 2022; 386(25): 2482-94 7 Lewis N et al.: ENRICH: ibrutinib plus rituximab vs chemoimmunotherapy in elderly patients with mantle cell lymphoma. ICML 2025 8 Viso C et al.: Outcomes in first relapsed-refractory younger patients with mantle cell lymphoma: results from the MANTLE-FIRST study. Leukemia 2021; 35(3): 787-95 9 Byrd JC et al.: Acalabrutinib vs. ibrutinib in previously treated chronic lymphocytic leukemia: results of the first randomized phase iii trial. J Clin Oncol 2021; 39(31): 3441-52 10 Seymour JF et al.: Detailed safety profile of acalabrutinib vs ibrutinib in previously treated chronic lymphocytic leukemia in the ELEVATE-RR trial. Blood 2023; 142(8): 687-99 11 Villa D et al.: Time to progression of disease and outcomes with second-line BTK inhibitors in relapsed/refractory mantle cell lymphoma. Blood Adv 2023; 7(16): 4576-85 12 Eyre TA et al.: Diagnosis and management of mantle cell lymphoma: A British Society for Haematology Guideline. Br J Haematol 2024 13 Wang M et al.: Ibrutinib plus venetoclax in relapsed or refractory mantle cell lymphoma (SYMPATICO): a multicentre, randomised, double-blind, placebo-controlled, phase 3 study. Lancet Oncol 2025; 26(2): 200-13 14 Novak U et al.: Combined therapy with ibrutinib and bortezomib followed by ibrutinib maintenance in relapsed or refractory mantle cell lymphoma and high-risk features: a phase 1/2 trial of the European MCL network (SAKK 36/13). EClinicalMedicine 2023; 64: 102221 15 Wang M et al.: Three-year follow-up of KTE-X19 in patients with relapsed/refractory mantle cell lymphoma, including high-risk subgroups, in the ZUMA-2 study. J Clin Oncol 2023; 41(3): 555-67 16 Wang ML et al.: Pirtobrutinib in covalent bruton tyrosine kinase inhibitor pretreated mantle-cell lymphoma. JClin Oncol 2023; 41(24): 3988-97 17 Aydilek E et al.: ICML 2025; Poster #273 18 Phillips TJ et al.: Glofitamab in relapsed/refractory mantle cell lymphoma: results from a phase I/II study. J Clin Oncol 2025; 43(3): 318-28
Das könnte Sie auch interessieren:
Kutane oder systemische Mastozytose – was macht die Hämatologie?
Mastzellerkrankungen sind eine heterogene Gruppe von Erkrankungen, die von einer Vielzahl zugrunde liegender genetischer Veränderungen und Komorbiditäten beeinflusst werden und in ihrem ...
Chinesische Studien mit zukunftsweisenden Ergebnissen
Asiat:innen sind an der Jahrestagung der ESMO mit vielen klinischen Studien aktiv beteiligt. Beim diesjährigen ESMO-Kongress schafften es auch mehrere der Studien mit innovativen ...
Ausgezeichnete Studien aus dem Bereich der Hämatologie
Im Rahmen der Jahrestagung der Deutschen, Österreichischen und Schweizerischen Gesellschaften für Hämatologie und Medizinische Onkologie werden jedes Jahr diverse Preise und ...