Nouvelles options thérapeutiques contre les exacerbations de l’asthme et de la BPCO
Compte-rendu:
Dr rer. nat. Torsten U. Banisch, journaliste médical
Reno Barth, journaliste médical
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Lors du congrès de l’ERS, les résultats d’études récentes sur le traitement de l’asthme et de la BPCO avec inflammation de type 2 par des anticorps monoclonaux ont été présentés. Entre autres, l’anticorps anti-IL-5 dépémokimab a permis d’obtenir une réduction significative des exacerbations dans l’asthme non contrôlé lors d’études de phase IIIa.
L’inflammation de type 2 est présente dans 80% des cas d’asthme sévère et peut être détectée de la manière la plus fiable par le nombre d’éosinophiles dans le sang», a expliqué le professeur David Jackson du King’s College de Londres. La cytokine interleukine 5 (IL-5) joue ici un rôle central et orchestre les effets multidirectionnels sur les cellules immunitaires.
Le dépémokimab, un anticorps anti-IL-5, est le premier et le seul médicament biologique de nouvelle génération à action ultra-longue ayant le potentiel d’inhiber durablement l’inflammation de type 2 à un intervalle d’administration de six mois chez les patient·es asthmatiques.
Réduction des exacerbations sous dépémokimab
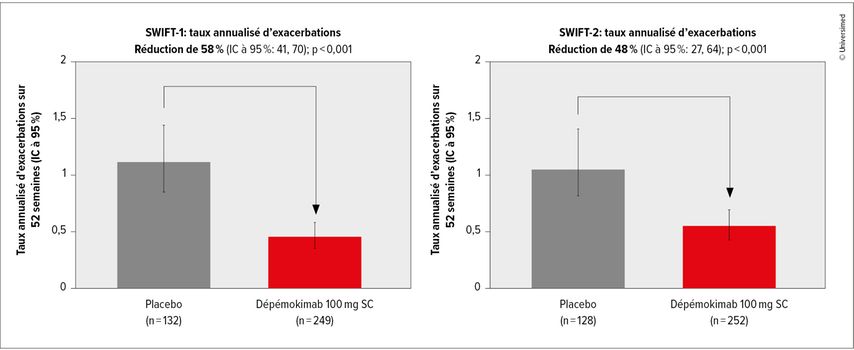
L’efficacité et la sécurité du dépémokimab ont été évaluées dans les études de phase IIIa SWIFT-1 (n=382) et SWIFT-2 (n=380). Le dépémokimab (100mg SC) a été utilisé comme traitement adjuvant à la semaine 0 et à la semaine 26 chez des patient·es souffrant d’asthme non contrôlé avec inflammation de type 2, malgré un traitement de première intention par des CSI à doses modérées à élevées. Le critère d’évaluation primaire des études SWIFT était le taux annualisé d’exacerbations à 52 semaines (Fig. 1).
Fig. 1: Les patient·es sous dépémokimab ont présenté moins d’exacerbations que les patient·es sous placebo dans les études de phase IIIa SWIFT-1 et SWIFT-2 (modifiée selon Jackson DJ et al. 2024)1
Ont été inclus·es les patient·es âgé·es de ≥12 ans présentant de l’asthme depuis ≥2 ans, traité·es au cours des 12 derniers mois par des corticostéroïdes inhalés (CSI) et depuis ≥3 mois par un traitement permanent supplémentaire. Le nombre d’éosinophiles dans le sang devait être ≥300cellules/μl au cours des 12 derniers mois ou ≥150cellules/μl au moment du dépistage, et les patient·es devaient avoir connu ≥2 exacerbations au cours des 12 derniers mois ayant nécessité l’utilisation d’un corticostéroïde systémique (SCS). Les patient·es ont été randomisé·es 2:1 et ont reçu le dépémokimab plus le traitement de première intention («standard of care», SOC) ou un placebo plus le SOC. Le dépémokimab a permis d’obtenir une réduction des exacerbations de 58% (SWIFT-1: IC à 95%: 41–70; p<0,001) et de 48% (SWIFT-2: IC à 95%: 27–64; p<0,001) par rapport au placebo. De plus, le taux annualisé d’exacerbations ayant nécessité une hospitalisation et/ou une visite aux urgences a été réduit de 72% par rapport au placebo (analyse groupée: RR: 0,28; IC à 95%: 0,13–0,61; p=0,002). Le délai de survenue d’une exacerbation a également été réduit de manière significative, un effet qui était déjà clairement visible après 4 semaines. Aucune diminution de l’effet n’a été documentée avant la deuxième dose.
Le dépémokimab a été bien toléré par les patient·es dans les deux études. Le taux d’effets secondaires était comparable à celui du placebo.1
Benralizumab: option thérapeutique pour l’asthme et la BPCO
«Les exacerbations de la BPCO et de l’asthme constituent un fardeau important pour les patient·es. Le phénotype à éosinophiles (T2) représente 30% des exacerbations de BPCO et 50% de celles d’asthme.2 L’exposition aux corticostéroïdes oraux est élevée et s’accompagne d’une morbidité accrue dans l’asthme et d’une mortalité accrue dans la BPCO. De même, l’effet du traitement est généralement de courte durée et le taux d’erreurs médicales est relativement élevé», a expliqué la professeure Mona Bafadhel du King’s College de Londres.
Le benralizumab est un anticorps monoclonal déjà utilisé dans le cadre de l’asthme à éosinophiles chronique sévère. Il réduit les éosinophiles3 et a récemment été testé dans une étude de preuve de concept en traitement adjuvant aux corticostéroïdes oraux. L’étude à double placebo randomisée, contrôlée, en double aveugle ABRA a cherché à déterminer si, en cas d’exacerbations à éosinophiles aiguës de la BPCO ou de l’asthme, une dose unique de benralizumab seul ou en association avec des glucocorticoïdes systémiques permettait d’obtenir un meilleur résultat que les glucocorticoïdes systémiques seuls. Elle a été menée sur des patient·es présentant un nombre d’éosinophiles ≥300cellules/μl. Dans l’étude à trois bras, les patient·es ont reçu soit (1) 30mg de prednisolone plus 100mg de benralizumab (par voie sous-cutanée), (2) prednisolone plus placebo ou (3) benralizumab plus placebo. Les patient·es inclus·es étaient âgé·es de 18 ans et plus, avaient un diagnostic d’asthme ou de BPCO, avaient connu une exacerbation au cours des 12 derniers mois et présentaient un nombre d’éosinophiles ≥250cellules/μl et, en cas d’exacerbation, ≥300cellules/μl. Le critère d’évaluation primaire de l’étude était les symptômes à 28 jours et les taux d’échec thérapeutique (définis par le décès, l’hospitalisation, le nouveau traitement) à 90 jours. Alors qu’un échec thérapeutique a été documenté chez 73,6% des patient·es sous prednisolone, seul·es 45,2% des patient·es sous benralizumab étaient concerné·es (OR: 0,264; IC à 95%: 0,125–0,556; p<0,001). En outre, la survenue de symptômes a également pu être réduite de manière significative sous benralizumab. Pour le critère d’évaluation secondaire, c’est-à-dire le délai jusqu’à l’échec thérapeutique, le traitement par le benralizumab a également permis d’obtenir des prolongations significatives (HR: 0,393; IC à 95%: 0,252–0,612; p<0,001). Une analyse de sous-groupe a en outre pu montrer qu’il n’y avait aucune différence entre le traitement par benralizumab plus prednisolone ou par benralizumab plus placebo en ce qui concerne les critères d’évaluation de l’étude. Les avantages du traitement par le benralizumab ont été observés chez les patient·es asthmatiques et chez ceux·elles atteint·es de BPCO ou d’asthme et de BPCO.4
Rémission clinique chez des enfants souffrant d’asthme de type 2 sous dupilumab
Chez les adultes souffrant d’asthme sévère, la rémission clinique se définit par l’absence durable d’exacerbations, la stabilisation de la fonction pulmonaire, le contrôle des symptômes et l’absence de besoin de corticostéroïdes oraux (OCS) pendant 12 mois. Une définition de la rémission clinique chez les enfants souffrant d’asthme modéré à sévère n’a pas encore été établie, selon le professeur Leonard Bacharier du Vanderbilt University Medical Center, à Nashville, aux États-Unis.
Le dupilumab est un anticorps monoclonal humain qui inhibe la signalisation des interleukines 4 et 13, les pilotes centraux de l’inflammation de type 2.5 L’étude de phase III VOYAGE a comparé l’effet du dupilumab à celui d’un placebo chez des enfants (n=408) âgés de 6 à 11 ans. 85,8% des patient·es souffraient d’asthme de type 2 et ont reçu 100mg ou 200mg de dupilumab (selon leur poids corporel) toutes les deux semaines pendant 52 semaines. Le critère d’évaluation primaire de l’étude était le nombre d’enfants ayant obtenu une rémission clinique. Celle-ci était définie par l’absence d’exacerbations, l’absence de besoin d’OCS, un score Z >–1,64 à la fois pour le rapport VEMS/CVF et pour le VEMS pré-bronchodilatation, et un score ACQ-5 <0,75 ou <1,5.
En utilisant un score ACQ-5 <0,75, une proportion significativement plus élevée d’enfants traités par le dupilumab ont obtenu une rémission clinique à la semaine 52 (41,9% par rapport à 23,7%; p=0,0008) par rapport au placebo. Des améliorations similaires ont été obtenues en appliquant un score ACQ-5 <1,5 (45,8% par rapport à 27,2%; p=0,0009). Outre une réduction des exacerbations sévères, une amélioration de la fonction pulmonaire et du contrôle de l’asthme a également été constatée.6 La question de savoir si la rémission obtenue s’avère curative par la suite est l’un des points suivis avec intérêt dans le cadre de cette étude clinique.
Dupilumab dans la BPCO
Les études BOREAS7 et NOTUS8 ont porté exclusivement sur des patient·es atteint·es de BPCO présentant un nombre élevé d’éosinophiles et des exacerbations fréquentes. Dans cette population, le dupilumab a réduit le nombre d’exacerbations de 30% et 34%, respectivement. Une amélioration de la fonction pulmonaire a également été démontrée.
Prise en compte des comorbidités
Outre les symptômes et les biomarqueurs sélectionnés, les comorbidités peuvent également indiquer la voie vers un traitement biologique adapté à chaque patient·e, a expliqué la professeure Florence Schleich de l’Université de Liège en Belgique.
Par exemple, le dupilumab est autorisé non seulement en cas d’asthme et de BPCO avec inflammation de type 2, mais aussi en cas de dermatite atopique, de rhinosinusite chronique avec polypes nasaux et d’œsophagite à éosinophiles. L’omalizumab est autorisé dans le traitement de l’urticaire et des polypes nasaux. Le mépolizumab est indiqué en cas de granulomatose éosinophilique avec polyangéite ainsi qu’en cas de syndrome hyperéosinophilique.
En présence de l’une de ces comorbidités, il est possible d’utiliser le même traitement pour l’asthme et la comorbidité. Il s’agit le plus souvent de polypes nasaux, qui touchent 44% des patient·es souffrant d’asthme sévère, a précisé F. Schleich. En ce qui concerne le traitement de l’asthme, les polypes nasaux sont même favorables en termes de pronostic, car les études ont montré qu’ils étaient des facteurs prédictifs d’une bonne réponse, y compris en ce qui concerne les symptômes de l’asthme.1 F.Schleich a également souligné les données issues de son centre, où les polypes nasaux étaient associés à une bonne réponse au traitement de l’asthme par un médicament biologique adapté. La plupart des patient·es présentant des polypes ont même été classé·es comme «super responders». F. Schleich a également souligné que la TSLP joue un rôle dans la formation des polypes et que le tézépélumab pourrait donc également être autorisé à l’avenir dans cette indication.
Loin d’être rare, l’association asthme sévère et dermatite atopique facilite considérablement le choix du médicament biologique, puisque seul le dupilumab est autorisé dans les deux indications. L’efficacité du dupilumab dans la dermatite atopique a été démontrée dans plusieurs études. Les hyperplasies de l’épiderme guérissent en quelques semaines sous dupilumab.9
Médicaments biologiques pendant la grossesse
Un autre facteur déterminant peut être la grossesse. F. Schleich a souligné que les meilleures données sur l’utilisation d’un médicament biologique contre l’asthme pendant la grossesse sont obtenues sous omalizumab. Elles proviennent d’une étude de registre portant sur plus de 200 patientes, qui ont été comparées aux données sur les femmes enceintes d’une cohorte canadienne de patientes asthmatiques. Celles-ci ne montrent aucune indication d’anomalies congénitales en cas d’utilisation d’omalizumab pendant la grossesse.10 Les données sur d’autres médicaments biologiques contre l’asthme sont nettement moins bonnes. Des registres correspondants sont donc nécessaires de toute urgence, selon F. Schleich.
Source:
Congrès de l’ERS, 7 au 9 septembre 2024, Vienne
Littérature:
1 Jackson DJ et al.: Twice-yearly depemokimab in severe asthma with an eosinophilic phenotype. NEJM 2024; doi: 10.1056/NEJMoa2406673 2 Bafadhel M et al.: Acute exacerbations of chronic obstructive pulmonary disease: identification of biologic clusters and their biomarkers. Am J Respir Crit Care Med 2011; 184(6): 662-71 3 Nowak RM et al.: A randomized trial of benralizumab, an antiinterleukin 5 receptor α monoclonal antibody, after acute asthma. Am J Emerg Med 2015; 33(1): 14-20 4 Ramakrishnan et al.: Lancet Respir Med 2024; in press 5 Vatrella A et al.: Dupilumab: a novel treatment for asthma. J Asthma Allergy 2014; 7: 123-30 6 Maspero JF et al.: Dupilumab efficacy in children with type 2 asthma receiving high/medium-dose ICS (VOYAGE). J Allergy Clin Immunol Pract 2024: S2213-2198(24)00858-4 7 Bhatt SP et al.: Dupilumab for COPD with type 2 inflammation indicated by eosinophil counts. N Engl J Med 2023; 389(3): 205-14 8 Bhatt SP et al.: Dupilumab for COPD with blood eosinophil evidence of type 2 inflammation. N Engl J Med 2024; 390(24): 2274-83 9 Guttman-Yassky E et al.: Dupilumab progressively improves systemic and cutaneous abnormalities in patients with atopic dermatitis. J Allergy Clin Immunol 2019;143(1): 155-72 10 Namazy JA et al.: Pregnancy outcomes in the omalizumab pregnancy registry and a disease-matched comparator cohort. J Allergy Clin Immunol 2020;145(2): 528-36.e1
Das könnte Sie auch interessieren:
Les conjugués anticorps-médicament ont le vent en poupe
Actuellement, de nombreux conjugués anticorps-médicament sont en cours d’évaluation dans le cancer du poumon. Qu’ils soient utilisés seuls ou en combinaison avec d’autres thérapies ...
Effets sur la santé ainsi que risques liés au travail posté et de nuit
Le travail posté et de nuit entraîne un risque accru de multiples problèmes de santé en raison de la perte de sommeil et de la désynchronisation circadienne. Il s’agit notamment de ...
Les défis des interfaces interdisciplinaires
Face à un éventail croissant d’options ciblées et immunothérapeutiques, les tests moléculaires sont de plus en plus au centre de l’attention dans les tumeurs gastro-intestinales. Des ...