Réduction des lipides au-delà du traitement par une statine: approches innovantes et expérimentales
Compte-rendu:
Reno Barth
Journaliste médical
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les statines sont devenues incontournables dans la prévention cardiovasculaire et pourraient, en cas de meilleure adhésion thérapeutique, permettre à une grande partie des patients à risque d’atteindre l’objectif de LDL. En cas de valeurs cibles très basses ou d’intolérance aux statines, des approches innovantes sont nécessaires. Plusieurs traitement de ce type, parfois avec d’autres objectifs, sont déjà utilisés dans la pratique clinique ou à des stades avancés. L’éventail thérapeutique va jusqu’à la thérapie génique à usage unique.
Keypoints
-
Une réduction radicale du C-LDL permet d’obtenir une régression des plaques pouvant atteindre 10% par an au niveau des sténoses.
-
Les premières études portant sur une thérapie génique visant à réduire le C-LDL ont commencé.
-
Plusieurs stratégies ciblant le facteur de risque lipoprotéine(a) font l’objet d’études cliniques.
-
Les données relatives à la réduction des triglycérides au moyen de fibrates sont hétérogènes.
-
L’acide bempédoïque en association avec l’ézétimibe chez les patients intolérants aux statines a été intégré dans les directives de l’ESC.
Selon le professeur Lorenz Räber de l’Hôpital universitaire de Berne, des études sur les mutations «gain of function» et «loss of function» ont conduit à une série de nouveaux développements dans les traitements hypolipidémiants. Les anticorps monoclonaux dirigés contre la PCSK9 sont utilisés dans la pratique clinique depuis quelques années. L’inclisiran, un «small interfering RNA» (siRNA) qui inhibe la transcription du gène codant PCSK9, est également autorisé. De petites molécules pouvant être prises par voie orale sont en cours de développement et devraient empêcher l’interaction de la PCSK9 avec les récepteurs hépatiques des LDL. En outre, il est envisagé d’éliminer définitivement la production de PCSK9 par l’édition de gènes au moyen de CRISPR-Cas9. Jusqu’à présent, dix patients atteints d’hypercholestérolémie familiale ont reçu cette thérapie génique. L’étude est encore en cours, précise L.Räber.
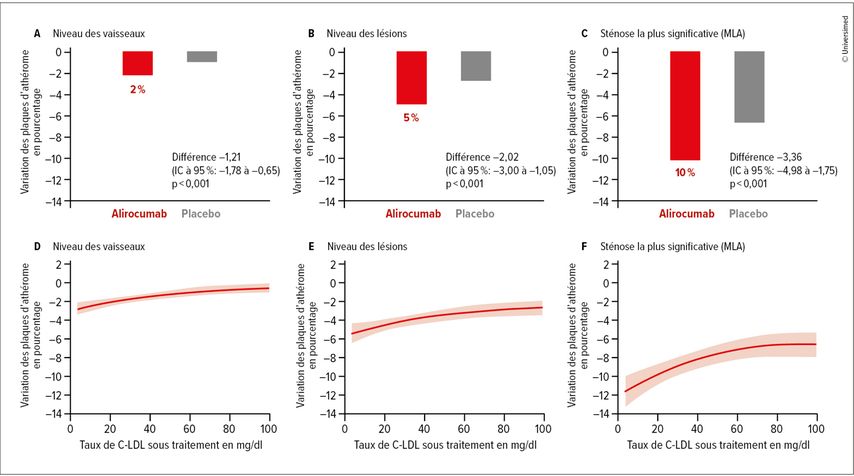
Pour les traitements mentionnés, des réductions du C-LDL entre 45 et 60% ont été démontrées ou sont au moins attendues dans les études encore en cours. Des effets directs sur les plaques d’athérome ont déjà été démontrés pour les deux inhibiteurs de la PCSK9 autorisés, l’évolocumab et l’alirocumab. Ils entraînent une régression des plaques de 2% par an. L.Räber a souligné que l’effet réel est toutefois plus net, d’autant plus que les 2% se rapportent à l’ensemble du système vasculaire. Au niveau des lésions, il est en revanche possible d’atteindre 5% et une régression des plaques de 10% a été démontrée dans les sections présentant les sténoses les plus significatives, comme le montrent les données présentées dans le cadre du congrès 2024 de l’ESC (Fig. 1).1 C’est pourquoi les directives de l’ESC recommandent d’initier immédiatement un inhibiteur de la PCSK9 (iPCSK9) en plus d’une statine et de l’ézétimibe après un syndrome coronarien aigu, si le C-LDL est supérieur à 1,4mmol/l.2
Fig.1:Effets de la réduction du C-LDL sous alirocumab au niveau des vaisseaux, des lésions ainsi que de la section présentant la sténose la plus significative («minimal lumen area», MLA) (modifiée selon Biccirè FG et al. 2024)1
L’inhibition de la PCSK9 influence l’ensemble des apolipoprotéines
Étude PACMAN-AMI
L’étude PACMAN-AMI, qui a porté sur 300 patients, a évalué l’effet de l’iPCSK9 alirocumab sur les plaques dans les artères coronaires. Les échantillons de sang longitudinaux prélevés pour cette étude permettent également d’analyser l’effet de l’alirocumab sur les apolipoprotéines. L’analyse a d’abord montré une augmentation rapide et compensatoire de la PCSK9, dont le taux plasmatique a augmenté de près de 1500% en un an. Parallèlement, on a observé une diminution de 75% de l’ApoB sous alirocumab par rapport à 43% sous placebo. Le C-LDL a diminué de 88% sous alirocumab par rapport à 54% sous placebo. L’alirocumab a en outre entraîné des diminutions significativement plus importantes des Apo C2, C3 et E par rapport au placebo. En revanche, le taux d’Apo(a) n’a pas changé sous alirocumab. Pour les auteurs, la diminution des apolipoprotéines indique un effet bénéfique de l’alirocumab au-delà de la réduction du C-LDL. Dans le cadre de la discussion, le professeur Heinz Drexel de l’hôpital régional de Feldkirch a souligné l’effet très rapide des iPCSK9 sur le taux de C-LDL.3 La sécurité des iPCSK9 est bien documentée dans des études à long terme.
Du nouveau sur l’inclisiran
Des données de sécurité sur une période de suivi de 3 ans sont également disponibles aujourd’hui pour l’inclisiran et n’indiquent aucun problème de sécurité.4,5
En outre, des données passionnantes sur la régression des plaques sous traitement par l’inclisiran ont été présentées dans le cadre du congrès ESC de cette année. Pour cette étude, des plaques riches en lipides ont été observées par spectroscopie dans l’infrarouge proche (NIRS) pendant 15 mois chez 36 patients atteints d’une maladie coronarienne stable et présentant une sténose de 20 à 50% dans une section proximale ou moyenne d’une artère coronaire. La NIRS permet de quantifier la teneur en lipides des lésions coronaires, indiquée par le maxLCBI4mm («Maximum Lipid-Core Burden Index [MaxLCBI] within 4mm»). Le maxLCBI4mm indique la teneur en lipides dans une zone spécifique d’une plaque et est utilisé dans les études cliniques pour mesurer la régression des plaques.
Les participants à l’étude ont pris une statine puissante (atorvastatine à 40 ou 80mg ou rosuvastatine à 20 ou 40mg) pendant 4 à 6 semaines, éventuellement en association avec l’ézétimibe. Lorsque l’objectif de C-LDL d’une valeur <1,8mmol/l n’a pas été atteint, l’inclisiran a été administré en plus. Sous ce schéma, la teneur en lipides des plaques d’athérome a diminué de manière significative en l’espace de 15 mois. On a observé une régression des plaques riches en lipides d’environ 35% chez 15 patients chez qui des plaques considérées comme riches en lipides par la NIRS avaient été détectées. Lorsque l’objectif de C-LDL de 1,8mmol/l a été atteint, la diminution de la teneur en lipides des plaques a été encore plus nette, avec près de 50%. Lorsque la valeur cible n’a pas été atteinte, on a constaté une régression numérique des plaques, qui n’a toutefois pas été significative.6
Prochaine cible: le facteur de risque génétique lipoprotéine(a)
Le facteur de risque lipoprotéine(a), ou Lp(a), est la prochaine cible dans la lutte contre les maladies cardiovasculaires (CV), selon le professeur Florian Kronenberg de l’Université de médecine d’Innsbruck. La Lp(a) est très similaire à la particule de LDL, mais elle comporte une chaîne d’apolipoprotéine(a) supplémentaire ainsi que des phospholipides oxydés. Environ 20% de la population présente des taux élevés de Lp(a), laquelle est tout au plus en corrélation minimale avec d’autres lipides plasmatiques. Son taux plasmatique est en grande partie déterminé génétiquement, ce qui fait de la Lp(a) l’un des principaux facteurs de risque génétique des maladies CV. Le risque CV augmente de manière linéaire avec l’augmentation des taux de Lp(a). Cela signifie en fin de compte que le risque individuel peut être nettement sous-estimé si la Lp(a) n’est pas mesurée.7
Malheureusement, les options thérapeutiques sont encore limitées, seule la LDL-aphérèse est disponible actuellement. La procédure est complexe, coûteuse, doit être réalisée fréquemment et peu de preuves sont disponibles à ce sujet. Comme l’aphérèse influence les taux plasmatiques de différents lipides, l’effet clinique de la réduction de la Lp(a) est difficile à mettre en évidence, a expliqué F.Kronenberg. Des études sont en cours sur l’utilisation d’oligonucléotides antisens. Une étude de phase III portant sur le pelacarsen chez plus de 8000 patients est en cours. Plusieurs siRNA font également l’objet d’études cliniques. Une réduction de la Lp(a) >90% a pu être démontrée sous olpasiran. Les résultats d’une étude de phase III sont attendus fin 2026. Une étude de phase III a également été lancée récemment sur le siRNA lépodisiran. L’étude sur le zerlasiran, un autre siRNA, devrait prochainement passer à la phase III. Un inhibiteur de petites molécules administré par voie orale est également en cours de développement. La muvalapline est censée empêcher la liaison de l’Apo(a) aux LDL et donc la formation de la Lp(a). Des réductions de la Lp(a) de l’ordre de 65% ont été obtenues au cours de la phase I, avec des effets comparables à différents dosages. Des problèmes liés à la détermination des taux plasmatiques de Lp(a) sont possibles ici, selon F.Kronenberg.8
Triglycérides: des contradictions et des questions en suspens
Des approches médicamenteuses innovantes sont également étudiées pour réduire les taux de triglycérides. Depuis de nombreuses années, on parle des triglycérides comme facteur de risque CV et, en effet, des études épidémiologiques montrent des corrélations importantes entre les triglycérides plasmatiques et le risque CV, selon la professeure Giovanna Liuzzo de l’université catholique du Sacré-Cœur de Rome. Les triglycérides doivent être considérés comme des marqueurs de la présence de lipoprotéines riches en triglycérides (TGRL) athérogènes. Il s’agit notamment des chylomicrons, des VLDL ainsi que des «remnants» (restes de chylomicrons ou de VLDL résultant de la dégradation de leurs triglycérides). Les TGRL pénètrent les parois des vaisseaux et contribuent au développement de cellules spumeuses et de plaques d’athérome.
Fibrates
Les résultats des études sont toutefois contradictoires en ce qui concerne le bénéfice CV des traitements hypotriglycéridémiants actuellement disponibles. Par exemple, l’étude PROMINENT n’a mis en évidence aucune réduction du risque CV. Cela peut toutefois être dû au fait que le pémafibrate étudié a certes entraîné une diminution des triglycérides, mais une augmentation du C-LDL.9 D’autres études portant sur les fibrates ont en revanche permis d’observer des réductions significatives du risque CV.10 «Pour obtenir un effet favorable sur les critères cardiovasculaires, il faut des traitements qui améliorent la clairance et éliminent les ‹remnants› au lieu de transformer les triglycérides en C-LDL», a déclaré G.Liuzzo.
Acides gras oméga-3
Les données relatives aux acides gras oméga-3 sont également hétérogènes. Alors que 2g d’acide eicosapentaénoïque (EPA) ont réduit le risque CV dans l’étude REDUCE-IT, l’association EPA plus acide docosahexaénoïque n’a eu aucun effet positif sur les critères cliniques dans l’étude STRENGTH, malgré une réduction comparable des triglycérides. Le choix de l’acide gras oméga-3 utilisé semble donc déterminant.11
Inhibition de l’apolipoprotéine C-III
Actuellement, plusieurs traitements hypotriglycéridémiants par inhibition de l’apolipoprotéine C-III (Apo C3) ou de l’ANGPTL3 sont en cours de développement. Les études cliniques portent sur l’oligonucléotide antisens olezarsen, l’«interfering RNA» plozasiran (tous deux dirigés contre l’Apo C3) ainsi que l’«interfering RNA» zodasiran dirigé contre l’ANGPTL3. Ils réduisent tous les triglycérides, mais diffèrent quant à leur action sur d’autres lipides. Les données relatives aux critères d’évaluation cliniques ne sont pas encore disponibles.
Acide bempédoïque: recommandation plus forte dans les directives
Alors que les statines interviennent dans la synthèse hépatique du cholestérol par inhibition de l’HMG-CoA réductase, il est également possible d’intervenir plus en amont dans ce processus et d’agir sur l’ATP citrate lyase (ACL). Dotée de ce mécanisme d’action, l’acide bempédoïque est déjà autorisé et utilisé dans la pratique clinique. «Le fait que l’acide bempédoïque soit une prodrogue et ne soit transformé en sa forme active de thioester que dans le foie, et non dans le muscle, est décisif pour la tolérance», a expliqué le professeur Ulf Landmesser du Centre allemand de cardiologie de la Charité (DHZC) à Berlin. L’acide bempédoïque offre donc une option intéressante pour les patients intolérants aux statines. Il faut également insister sur ce point lors de la consultation avec les patients, afin d’exclure un effet nocebo chez les patients qui ont fait de mauvaises expériences avec les statines, a déclaré U.Landmesser. Avec l’étude CLEAR Outcomes, on dispose entre-temps d’une étude des résultats qui révèle une réduction significative des événements indésirables cardiovasculaires majeurs (MACE) dans une population intolérante aux statines sur une période de 5 ans, dont l’ampleur correspond à la réduction du C-LDL obtenue.12,13
L’acide bempédoïque peut également être utilisé comme traitement adjuvant aux statines pour obtenir une réduction du C-LDL allant au-delà de l’effet des statines, comme l’a montré l’étude CLEAR Harmony.14 Dans cette population, l’acide bempédoïque a réduit le C-LDL moyen de 18,1% par rapport au placebo après 12 semaines, ce qui correspond à une réduction moyenne de 0,5mmol/l par rapport à la valeur initiale. Sur la base de ces données, les directives actuelles de l’ESC comportent désormais une recommandation Ib pour l’utilisation de l’acide bempédoïque en association avec l’ézétimibe chez les patients intolérants aux statines, ainsi qu’une recommandation IIa/c («should be considered») comme traitement adjuvant à un traitement par une statine, si les valeurs cibles ne sont pas atteintes avec une statine seule.
Une revue systématique avec méta-analyse des événements CV sous acide bempédoïque ou placebo a également été présentée au congrès 2024 de l’ESC. Toutes les études randomisées contrôlées par placebo disponibles sur l’acide bempédoïque ont été incluses dans l’analyse. Le critère d’évaluation primaire était les MACE en 3 points, regroupant infarctus du myocarde, accident vasculaire cérébral et décès CV. Au total, dix travaux portant sur 18200 participants à l’étude ont été identifiés. L’évaluation a montré une réduction significative des MACE sous acide bempédoïque par rapport au placebo (OR: 0,84 [IC à 95%: 0,76–0,96]; p<0,001; I2=0%). Le pilote de ce résultat était une réduction significative des infarctus du myocarde non fatals, alors qu’aucun effet significatif n’a été observé sur les accidents vasculaires cérébraux ou la mortalité globale.15
Source:
Congrès de l’ESC, 30 août au 2 septembre 2024, Londres
Littérature:
1 Biccirè FG et al.: JAMA Cardiol 2024; e243200 2 Byrne RA et al.: Eur Heart J 2023; 44: 3720-3826 3 Schmidt L et al.: Beyond C-LDLholesterol: effects of alirocumab on the human apolipoproteome. Presented at ESC 2024 4 Wright RS et al.: Cardiovasc Res 2024: 120; 140-10 5 Wright RS et al.: J Am Coll Cardiol 2023; 82: 2251-61 6 Kokina B et al.: Inclisiran-containing low-density lipoprotein cholesterol reduction effectively stabilizes atherosclerotic plaques. Presented at ESC 2024 7 Kronenberg F: Curr Atheroscler Rep 2024; 26: 75-82 8 Nicholls SJ et al.: JAMA 2023; 330: 1042-53 9 Das Pradhan A et al.: N Engl J Med 2022; 387: 1923-34 10 Nordestgaard BG, Varbo A: Lancet 2014; 384: 626-35 11 Tybjærg-Hansen A et al.: Eur Heart J 2023; 44: 4196-8 12 Nissen SE et al.: N Engl J Med 2023; 388: 1353-64 13 HPS3/TIMI55–REVEAL Collaborative Group: N Engl J Med 2017; 377: 1217-27 14 Ray KK et al.: N Engl J Med 2019; 380: 1022-32 15 Mutschlechner D et al.: Cardiovascular events in patients treated with bempedoic acid vs. placebo: systematic review and meta-analysis. Presented at ESC 2024
Das könnte Sie auch interessieren:
Les conjugués anticorps-médicament ont le vent en poupe
Actuellement, de nombreux conjugués anticorps-médicament sont en cours d’évaluation dans le cancer du poumon. Qu’ils soient utilisés seuls ou en combinaison avec d’autres thérapies ...
Effets sur la santé ainsi que risques liés au travail posté et de nuit
Le travail posté et de nuit entraîne un risque accru de multiples problèmes de santé en raison de la perte de sommeil et de la désynchronisation circadienne. Il s’agit notamment de ...
Les défis des interfaces interdisciplinaires
Face à un éventail croissant d’options ciblées et immunothérapeutiques, les tests moléculaires sont de plus en plus au centre de l’attention dans les tumeurs gastro-intestinales. Des ...