Neuer Therapieansatz mit Interleukin-5-Antagonisten
Bericht:
Dr. Felicitas Witte
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bisher ist die eosinophile Granulomatose mit Polyangiitis (EGPA), die mit Vaskulitis und eosinophiler Organinfiltration einhergeht, nicht heilbar. Die Krankheit rezidiviert häufig und immer wieder kommt es zu schwerem Organbefall. Hoffnung auf eine wirksamere Therapie machen Interleukin-5-Antagonisten. Erste Ergebnisse sind vielversprechend.
Die EGPA, früher als Churg-Strauss-Syndrom bezeichnet, kann die Lebensqualität der Patienten deutlich einschränken und durch den Organbefall die Lebenszeit verkürzen. Die Prävalenz der EGPA beträgt in Studien zwischen 10,7 und 22,3 pro 1 Million Personen und erfüllt damit die Kriterien für eine seltene Erkrankung.1
Zusammen mit der Granulomatose mit Polyangiitis (GPA, früher Wegener-Granulomatose) und der mikroskopischen Polyangiitis (MPA) gehört die EGPA zu den ANCA-assoziierten Vaskulitiden, obwohl ANCA (antineutrophile cytoplasmatische Antikörper) bei der EGPA nur bei etwa 30–40% der Patienten detektierbar sind.
Schwere Verläufe der EGPA äußern sich unter anderem durch Herzbefall oder eine schwere Neuropathie. Ziel der Therapie ist zunächst eine Remissionsinduktion, gefolgt von einem Remissionserhalt. Grundlage der Behandlung sind orale Glukokortikoide. Je nach Schwere der Erkrankung kommen Immunsuppressiva (DMARDs) hinzu. Manchmal wird die Remissionsinduktion auch direkt damit gestartet.2 Heilen lässt sich die Krankheit bisher nicht. Sie rezidiviert häufig und immer wieder kommt es zu einem refraktären Verlauf mit schwerem Organbefall.
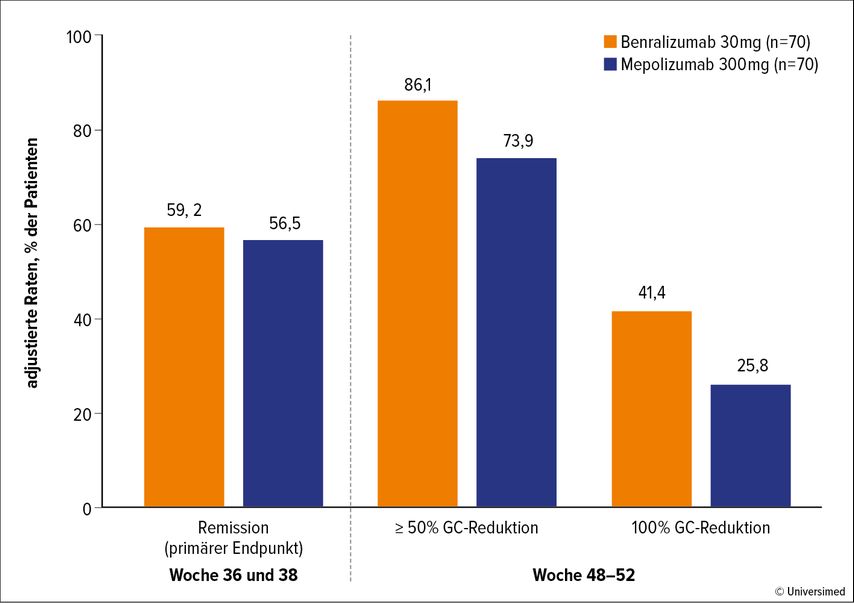
Abb. 1: Wirksamkeit der beiden IL-5-Antagonisten in der MANDARA-Studie, die auf dem Kongress des American College of Rheumatology vorgestellt wurde (nach Wechsler et al., 2023)5
Anstoß der Apoptose
Mit Aufkommen zielgerichteter Therapien stehen auch für die Behandlung der EGPA neue Behandlungsmöglichkeiten zur Verfügung. Sinn scheint die Blockade von Interleukin-5 (IL-5) zu haben. Denn IL-5 ist essenziell für die Reifung, Differenzierung und das Überleben der Eosinophilen, die bei der EGPA im Übermaß vorkommen. Der IL-5-Rezeptor wird spezifisch auf der Oberfläche von Eosinophilen und Basophilen exprimiert. In der MIRRA-Studie von 2017, einer randomisierten, placebokontrollierten Studie mit 136 Patienten, führte der IL-5-Hemmer Mepolizumab eher zu einer Remission als Placebo und die Patienten benötigten weniger Glukokortikoide.3 Doch auch mit Mepolizumab erreichten mehr als die Hälfte der Patienten keine dauerhafte Remission.
Der monoklonale Antikörper Benralizumab bindet an die Alpha-Untereinheit des IL-5-Rezeptors (IL-5Rα) und verhindert die Bindung von IL-5 an seinen Rezeptor auf den Eosinophilen und damit die Reifung und Differenzierung dieser Zellen. Außerdem hat Benralizumab eine hohe Affinität zu den FcyRIII-Rezeptoren auf Immunzellen, unter anderem auf den natürlichen Killerzellen. Die Bindung an die FcyRIII-Rezeptoren löst eine antikörperabhängige zellvermittelte Zytotoxizität aus, was letztendlich zur Apoptose von Eosinophilen und Basophilen führt und so die eosinophile Entzündung reduziert.
Benralizumab wurde 2018 von der Europäischen Kommission für eine Add-on-Erhaltungstherapie bei Erwachsenen mit schwerem eosinophilem Asthma, das trotz hoch dosierter inhalativer Glukokortikoide in Kombination mit lang wirksamen Betasympathomimetika nicht genügend kontrolliert ist, zugelassen. In den USA ist Benralizumab seit 2017 zugelassen, ebenfalls für Patienten mit schwerem eosinophilem Asthma, aber schon ab 12 Jahren. In der Schweiz ist Benralizumab nur für Erwachsene mit schwerem eosinophilem Asthma als Zusatz zur Erhaltungstherapie zugelassen.
Mepolizumab ist in der Europäischen Union zugelassen als Zusatzbehandlung bei schwerem, refraktärem eosinophilem Asthma ab dem Alter von 6 Jahren, bei chronischer Rhinosinusitis mit Nasenpolypen, bei unzureichend kontrolliertem hypereosinophilem Syndrom ohne erkennbare nichthämatologische sekundäre Ursache und bereits auch zur Behandlung einer EGPA, und zwar als Zusatzbehandlung für Kinder und Erwachsene ab 6 Jahren mit schubförmig remittierender oder refraktärer EGPA. In den USA ist Mepolizumab ebenfalls zugelassen, wie auch in der Schweiz, und zwar ab 12 Jahren gegen schweres eosinophiles Asthma, ab 18 Jahren gegen chronische Rhinosinusitis mit Nasenpolypen, ab 18 Jahren bei EGPA und ab 12 Jahren gegen das Hypereosinophilie-Syndrom.
Klinik gebessert, weniger Kortikoide
Nun testete Alessandra Bettiol von der Universität in Florenz mit einem internationalen Team die Wirksamkeit von Benralizumab bei EGPA.4 Sie schlossen in ihre retrospektive Studie 121 Patienten mit rezidivierend-refraktärer EGPA aus 6 europäischen Ländern ein. Die Patienten waren zwischen 2019 und 2022 mit Benralizumab behandelt worden, und zwar mit der Dosis, die für das eosinophile Asthma zugelassen ist: 30mg subkutan dreimal alle 4 Wochen, danach alle 8 Wochen. Das Follow-up dauerte 12 Monate. Ob ein Patient auf die Therapie ansprach, wurde mit dem Birmingham Vasculitis Activity Score (BVAS) gemessen. Ein BVAS von 0 unter ≤4,0mg Prednisolon/Tag bedeutete eine komplette Remission und ein BVAS von 0 mit >4,0mg Prednisolon täglich entsprach einem teilweisen Ansprechen.
Nach 3 Monaten hatten 15 von 121 Patienten (12,4%) komplett angesprochen. Nach 6 Monaten gab es Follow-up-Daten zu 87 Patienten, von diesen hatten 25 (28,7%) komplett angesprochen. Nach einem Jahr gab es nur noch Daten zu 69 Patienten, bei 32 von ihnen (46,4%) war ein komplettes Ansprechen erreicht worden. Im Laufe des Beobachtungszeitraums besserte sich die Lungenfunktion und die Patienten benötigten weniger Glukokortikoide.
19 von 121 Patienten erlitten Nebenwirkungen. 6 wurden als nicht schwerwiegend eingestuft und umfassten Kopfschmerzen, Fieber, Muskelschmerzen, Lungenentzündung, Sinusitis, Ausschlag und lokale Reaktionen an der Injektionsstelle. 3 unerwünschte Ereignisse waren so schwer, dass die Patienten deswegen im Spital behandelt werden mussten, und zwar wegen eines Asthmaanfalls, einer Knochenfraktur und einer antibiotikabedürftigen Zellulitis im Gesicht. Aus der Studie geht nicht hervor, ob die behandelnden Ärzte dies im Zusammenhang mit der Studienmedikation sehen, denn eine Kausalitätsprüfung wurde nicht gemacht, als die Nebenwirkungen auftraten.
16 Patienten brachen die Therapie mit Benralizumab ab, meistens weil das Medikament nicht wirkte, einmal aber wegen der Nebenwirkungen.
Mehr als die Hälfte der Patienten erreichten mit Benralizumab keine komplette Remission, wobei zu berücksichtigen ist, dass eine komplette Remission mit einer oralen Glukokortikoiddosis von ≤4,0mg pro Tag in dieser Studie recht streng definiert war.
Erster Head-to-Head-Vergleich
Mehr Informationen zur Wirksamkeit von Benralizumab, insbesondere im Vergleich zu Mepolizumab, sollte die MANDARA-Studie bringen, eine prospektive Head-to-Head-Studie zu Benralizumab und Mepolizumab.5 Erste Ergebnisse wurden auf dem Kongress des American College of Rheumatology vorgestellt. Die Studie ist wie die vorher erwähnte von Bettiol et al. vom Hersteller von Benralizumab, AstraZeneca, gesponsert. Die MANDARA-Studie ist eine Phase-III-Studie. Eingeschlossen waren 140 Patienten über 17 Jahre mit dokumentierter EGPA, die orale Glukokortikoide in einer Dosis von ≥7,5mg Prednison/Prednisolon/Tag und allenfalls eine immunsuppressive Therapie für 4Wochen oder länger benötigten. Die Teilnehmer erhielten 1:1 randomisiert entweder subkutan 30mg Benralizumab oder dreimal 100mg Mepolizumab alle 4 Wochen für ein Jahr. Primärer Endpunkt war der Anteil der Patienten, die nach 36 und 48 Wochen in Remission waren. Auch hier war komplette Remission definiert als BVAS 0 und orale Glukokortikoide ≤4,0mg pro Tag.
Der primäre Endpunkt der Studie (Nichtunterlegenheit von Benralizumab gegenüber Mepolizumab) wurde erreicht. Nach 36 bzw. 48 Wochen waren 59,2% der Patienten mit Benralizumab und 56,5% der Patienten mit Mepolizumab in Remission. Der Unterschied von 2,71 Prozentpunkten war nicht signifikant (p=0,7278), was auf Nichtunterlegenheit von Benralizumab gegenüber Mepolizumab weist.
Benralizumab wirkt also mindestens ebenso gut wie Mepolizumab. Das Nebenwirkungsprofil war vergleichbar. Nach 48–52 Wochen brauchten 86,1% mit Benralizumab bzw. 73,9% mit Mepolizumab nur noch halb so viel Glukokortikoide oder weniger. Bei 41,4% bzw. 25,8% konnte das Kortison voll ausgeschlichen werden. 90% der Patienten mit Benralizumab und 95,7% derjenigen mit Mepolizumab berichteten über unerwünschte Ereignisse. Das waren am häufigsten eine Covid-19-Infektion (21,4% bzw. 27,1%), Kopfschmerzen (17,1% vs. 15,7%) sowie Arthralgien (17,1% vs 11,4%). Schwerwiegende unerwünschte Wirkungen wurden bei 5,7% mit Benralizumab und 12,9% mit Mepolizumab registriert. Kein Patient mit Benralizumab und zwei Patienten mit Mepolizumab brachen die Therapie wegen Nebenwirkungen ab. Welcher der beiden IL-5-Antagonisten sich durchsetzen wird, werden weitere Studien zeigen.
Literatur:
1 Mohammad AJ et al.: An update on the epidemiology of ANCA-associated vasculitis. Rheumatology 2020; 59(Suppl 3): iii42-50 2 Groh M et al.: Eosinophilic granulomatosis with polyangiitis (Churg-Strauss) (EGPA) Consensus Task Force recommendations for evaluation and management. Eur J Intern Med 2015; 26(7): 545-53 3 Wechsler ME et al.: Mepolizumab or placebo for eosinophilic granulomatosis with polyangiitis. N Engl J Med 2017; 376: 1921-32 4 Bettiol A et al.: Benralizumab for eosinophilic granulomatosis with polyangiitis: a retrospective, multicentre, cohort study. Lancet Rheumatol 2023; 5(12): e707-15 5 Wechsler M et al.: Efficacy and safety of benralizumab compared with mepolizumab in the treatment of eosinophilic granulomatosis with polyangiitis in patients receiving standard of care therapy: phase 3 MANDARA study. ACR 2023; Abstract L14
Das könnte Sie auch interessieren:
„Sehr sinnvoller Therapieansatz“
In einer Studie besserte der gegen den Interleukin-5-Rezeptor gerichtete Antikörper Benralizumab den klinischen Verlauf von Patienten mit eosinophiler Granulomatose mit Polyangiitis ( ...
Schwierig zu behandelnde oder therapierefraktäre SpA
Die Behandlungsmöglichkeiten bei Spondyloarthritis haben sich mit Einführung der Biologika dramatisch verbessert. Das bedeutet allerdings nicht, dass alle Patient:innen in ausreichendem ...
Biologikatherapien in der Schwangerschaft
„Biologika sind in der Schwangerschaft in Ordnung“ – mit dieser klaren Aussage fasste Prof.Dr. Ian Giles, University College London, im Rahmen der RheumaPreg-2025- Konferenz in Wien die ...